Que permet la technologie d’imagerie que vous proposez ?
Ting-Di Wu : Pour expliquer simplement, le NanoSIMS a la capacité unique de détecter de manière simultanée et in situ plusieurs isotopes à partir d’un micro-volume d’analyse. Il permet de cartographier la répartition élémentaire et isotopique d’une surface à l’échelle subcellulaire, avec une résolution pouvant atteindre 50 nanomètres. Dans le champ biomédical, cela permet notamment l’étude des métabolismes, des mécanismes de régénération cellulaire ou encore du devenir de traceurs isotopiques. L’instrument est particulièrement adapté à l’analyse d’échantillons présentant de très fines structures et une composition hétérogène.
Comment avez-vous développé votre expertise autour du NanoSIMS ?
T.-D. W : Je me suis d’abord formé à l’Université Tsinghua en Chine avant d’obtenir une bourse pour venir préparer une thèse en France. J’ai été accueilli au sein du laboratoire de Physique des solides à l’Université Paris-Sud, dans le groupe dédié à la micro-analyse. C’est là que je me suis initié à l’instrumentation scientifique et que j’ai rencontré Georges Slodzian, le concepteur du NanoSIMS. Nous avons noué une collaboration – et une amitié – qui se poursuivent encore aujourd’hui. Le professeur Slodzian fêtera ses 91 ans cette année, et continue de venir au laboratoire faire des expériences sur notre NanoSIMS à Curie.
Nous collaborons depuis plus de dix ans pour améliorer l’instrument. Deux avancées ont fait l’objet de publications : l’une porte sur l’optimisation de la transmission des ions secondaires, l’autre sur l’amélioration du pouvoir de séparation en masse. Ce dernier paramètre est essentiel en spectrométrie, car il permet de distinguer différentes espèces ioniques, malgré les nombreuses interférences possibles. Il s’avère particulièrement utile pour analyser le deutérium en présence d’autres éléments.
Actuellement, nous travaillons sur la formation de la sonde primaire au césium — le petit jet d’ions qui permet d’analyser les échantillons — afin de la rendre plus « brillante », c’est-à-dire plus intense, mieux focalisée et donc plus performante pour explorer la composition chimique hétérogène des échantillons. Nos derniers essais sont très encourageants : ils montrent que, même sans modifier la source d’ions elle-même, on peut, grâce à une simulation d’optique, ajuster finement les paramètres pour augmenter considérablement la brillance de la sonde. Cela permet une analyse plus précise, y compris dans des zones extrêmement réduites.
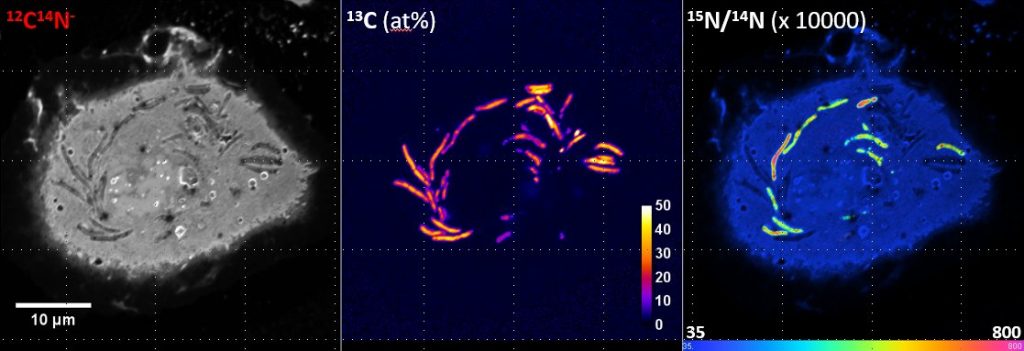
Qui utilise le NanoSIMS actuellement ?
T.-D. W : Il faut comprendre que nous sommes sur une technologie extrêmement rare et encore peu connue dans le milieu biomédical. À l’heure actuelle, seulement trois équipements de ce type sont opérationnels en France, parmi une soixantaine présents dans le monde, tous domaines d’application confondus.
Nous accueillons des utilisateurs issus d’institutions académiques du monde entier — États-Unis, Canada, Allemagne, Japon — en plus de nombreux partenaires français. Une partie de nos projets actuels dépasse le champ biomédical : nous travaillons par exemple avec des cosmochimistes sur l’analyse d’anomalies isotopiques dans des échantillons de météorites, ou encore avec des spécialistes des matériaux semiconducteurs pour étudier des structures fines.
Vous voulez dire que le NanoSIMS est encore sous-utilisé en recherche biomédicale ?
T.-D. W : Il faut relativiser, car aux plans national et international nous travaillons sur de beaux projets en biologie santé. Au niveau national, l’instrument a par exemple été mis à contribution par l’équipe d’Olivier Neyrolles, pour ses recherches sur la tuberculose et le métabolisme des mycobactéries. Nous avons montré que la bactérie responsable de la tuberculose utilise préférentiellement un nutriment appelé aspartate comme source d’azote pour se développer à l’intérieur des cellules.
À l’échelle internationale, nous avons collaboré avec l’université Harvard dans le cadre d’une étude pionnière en cardiologie initiée par Claude Lechêne, que nous prolongeons actuellement avec ses étudiants. Cette dernière visait à trancher un débat de fond : les cellules cardiaques adultes se renouvellent-elles grâce à des cellules souches ou à des cellules préexistantes ? Grâce au marquage isotopique à l’azote 15 et à la capacité du NanoSIMS à détecter ce traceur au niveau des noyaux de cellules nouvellement créées, l’équipe a pu conclure que ce sont les cellules préexistantes qui assurent ce renouvellement, aussi lent soit-il.
L’un des principaux freins pour une application biomédicale est la préparation des échantillons biologiques. Elle nécessite plusieurs étapes très encadrées pour aboutir : culture cellulaire, marquage isotopique, déshydratation, inclusion en résine… La moindre erreur peut altérer la distribution chimique de l’échantillon. De plus, les tissus biologiques demandent une vigilance accrue, par exemple en termes de conservation ou de choix des traceurs. La préparation des échantillons solides, comme les roches ou les matériaux, est plus directe. Pour contourner cette difficulté, nous recommandons au scientifique de se faire accompagner par une plateforme d’imagerie locale pour préparer son échantillon. Les experts en microscopie électronique maîtrisent les protocoles et peuvent adapter la préparation aux exigences du NanoSIMS.
Quel accompagnement proposez-vous aux équipes de recherche ?
Nous proposons un accompagnement dès la conception du protocole, pour garantir la meilleure exploitation des capacités de l’instrument. Il ne faut pas hésiter à nous contacter dès la naissance du projet. Bien sûr, nous assistons les équipes sur tout le continuum de recherche, notamment pour l’interprétation des résultats.

