Le microbiote sous étroite surveillance
Nathalie Vergnolle. Unité 1220 Inserm / Inrae / École nationale vétérinaire / Université Toulouse III-Paul-Sabatier
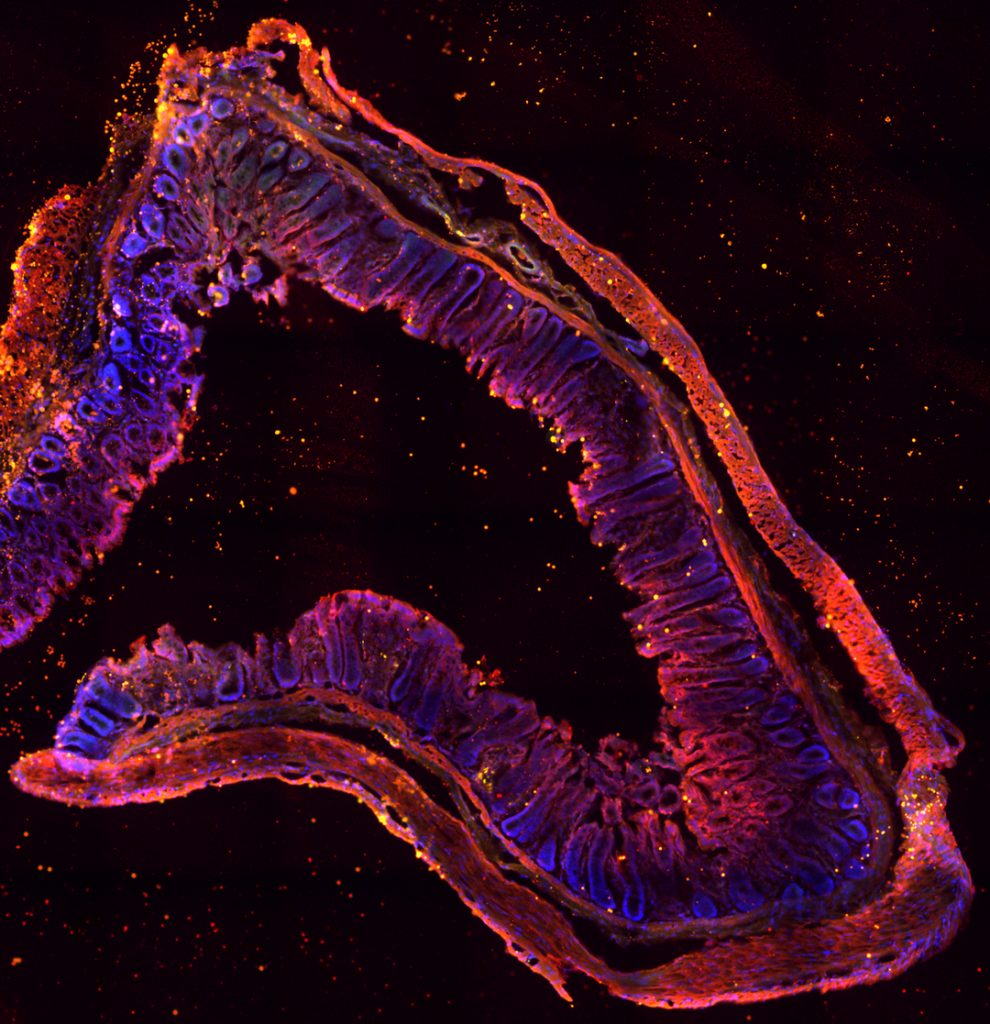
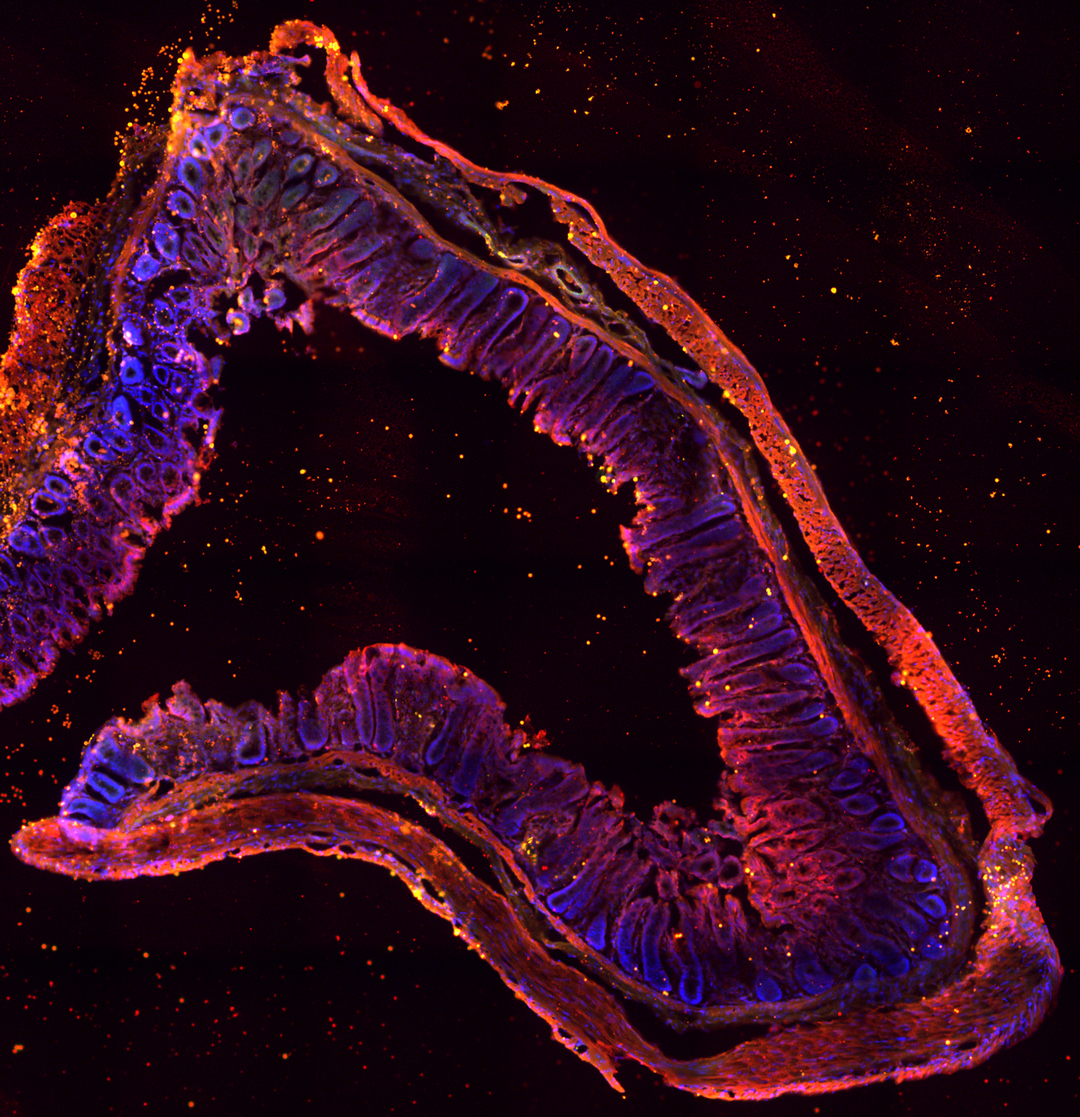
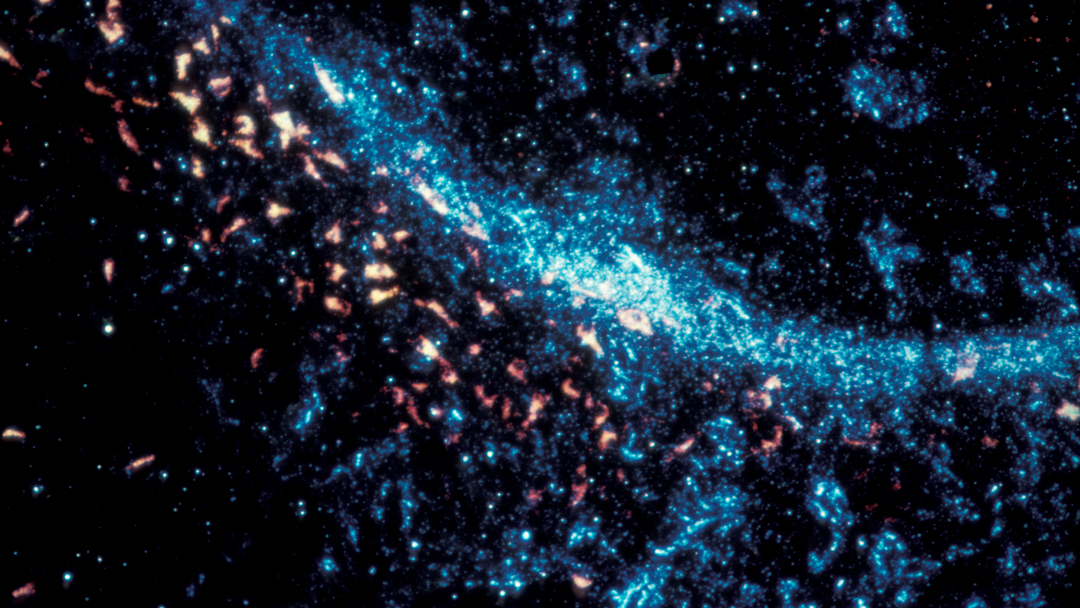
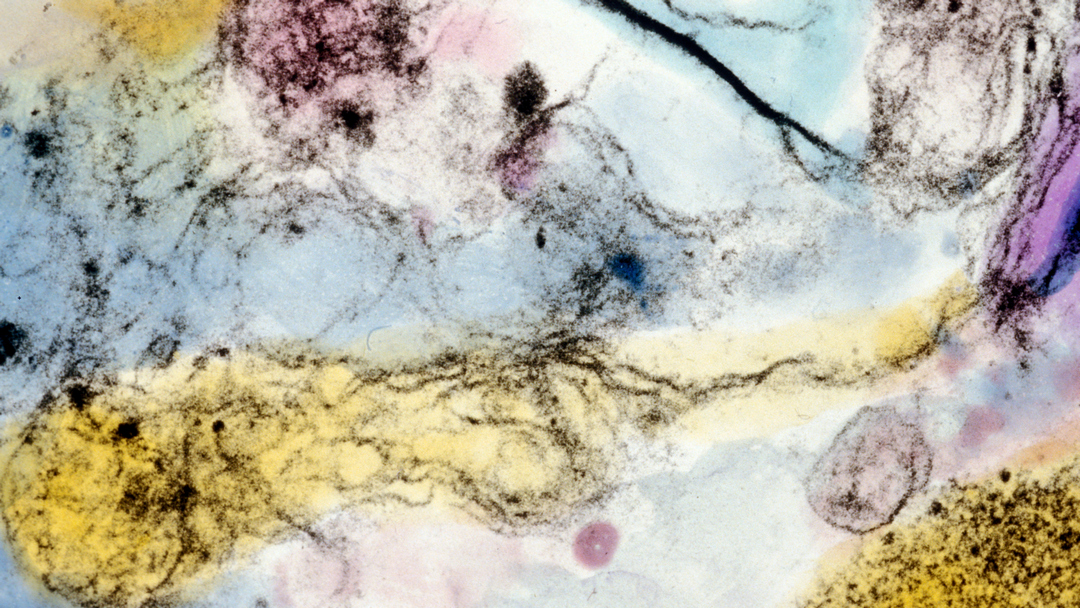
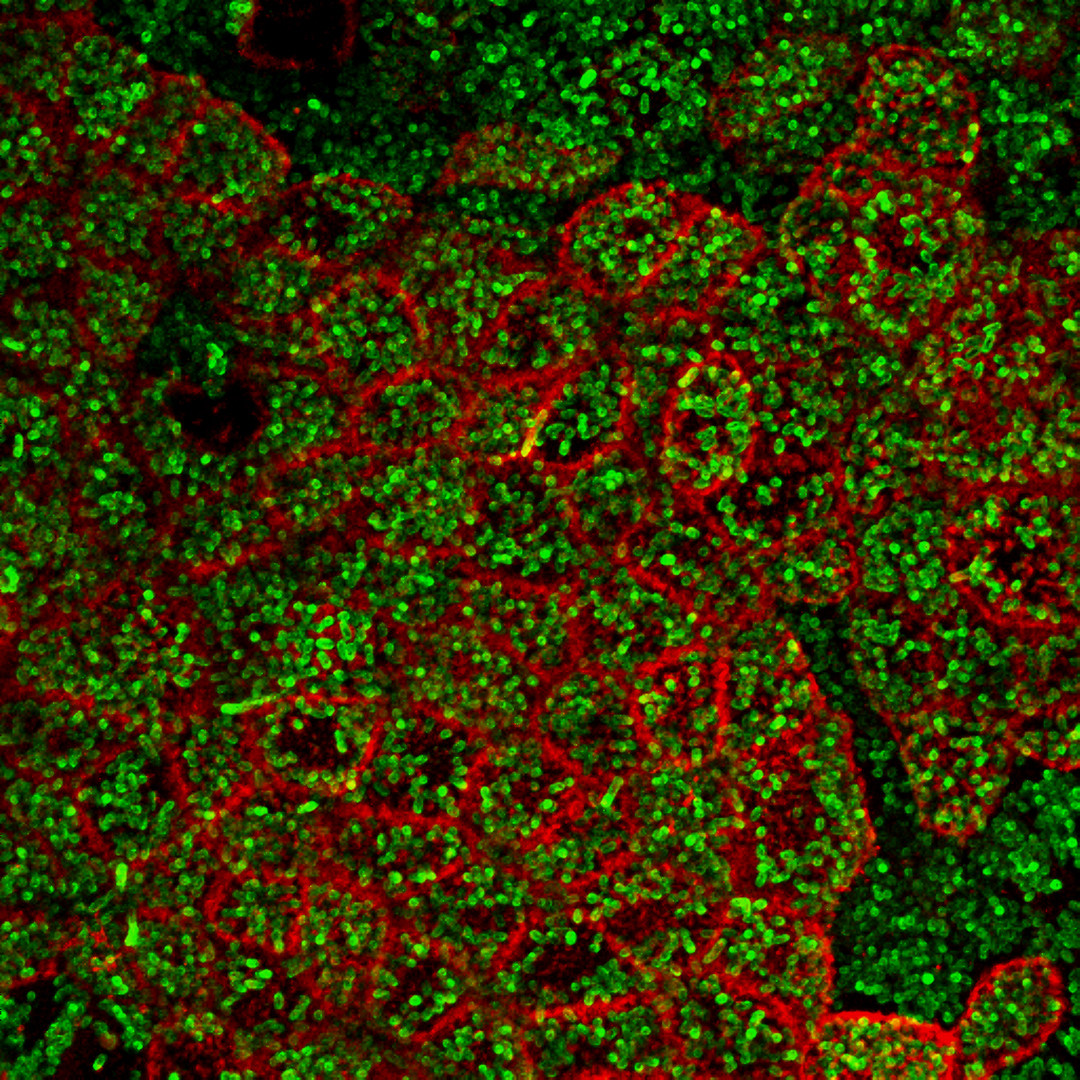
Les chercheurs ne s’attendaient pas à la voir là… La thrombine est une enzyme produite par le foie, et dont l’action coagulante est utilisée pour stopper les hémorragies. Récemment, on a découvert qu’elle était aussi présente dans l’intestin. Mais que fait-elle à cet endroit ? De toute évidence, elle surveille le microbiote. L’équipe de Nathalie Vergnolle, Prix Recherche Inserm 2018, à l’Institut de recherche en santé digestive à Toulouse, a observé que lorsque la thrombine est absente, les bactéries du microbiote intestinal pénètrent dans la paroi de l’intestin et se faufilent même jusque dans les tissus avoisinants. En agissant sur des protéines de la matrice du microbiote, elle maintient la structure de ce dernier, protégeant l’organisme d’éventuelles infections. La régulation est réciproque puisqu’en l’absence de microbiote, la thrombine n’est pas synthétisée dans l’intestin. Cette découverte pourrait expliquer les saignements de l’intestin qui apparaissent lors du traitement de maladies cardiovasculaires : attaquée par les médicaments, la thrombine ne serait plus en mesure de protéger cet organe.
Chez l’humain, le microbiote intestinal est composé d’environ 100 000 milliards de bactéries et pèse entre 1 et 5 kg.
Quand les lipides protègent le cœur
Marie-Caroline Michalski. Unité 1060 Inserm / Inrae / Insa / Université Claude-Bernard-Lyon 1, Laboratoire de recherche en cardiovasculaire, métabolisme, diabétologie et nutrition
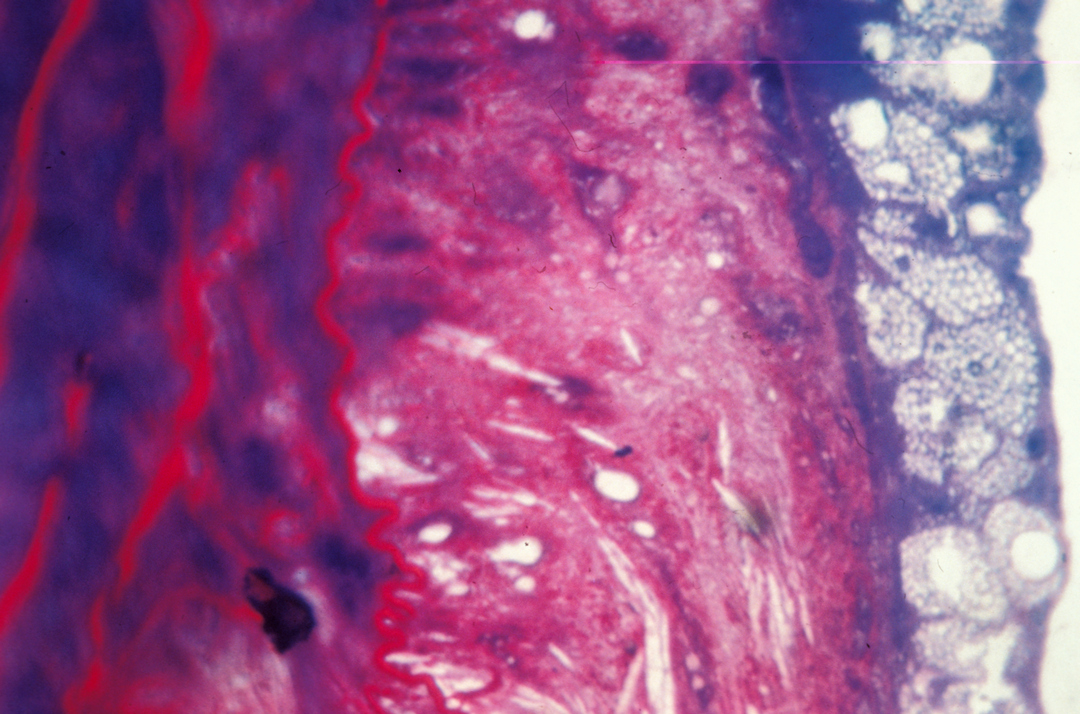
Des lipides présents dans les produits laitiers peuvent contribuer à diminuer le risque cardiovasculaire. C’est ce que montrent des travaux dirigés par Marie-Caroline Michalski, du laboratoire lyonnais CarMeN, et menés auprès de femmes ménopausées et en surpoids – donc particulièrement à risque sur le plan cardiovasculaire. Ils indiquent que certains lipides – les lipides polaires – contenus dans les produits laitiers auraient une action protectrice. Les femmes qui ont participé à l’étude ont suivi pendant un mois un régime enrichi en lipides polaires, à raison de 5 grammes par jour, absorbés par l’intermédiaire d’un concentré de babeurre. Elles ont alors vu leur taux de « mauvais » cholestérol diminuer. Comment ? Dans l’intestin, ces lipides peuvent se lier au cholestérol et former des complexes qui n’ont pas la faculté d’être assimilés et sont donc rejetés dans les selles. Ces résultats pourraient ouvrir la voie à de nouvelles stratégies nutritionnelles pour les personnes à risque, et inciter les industriels à enrichir leurs produits en lipides polaires laitiers
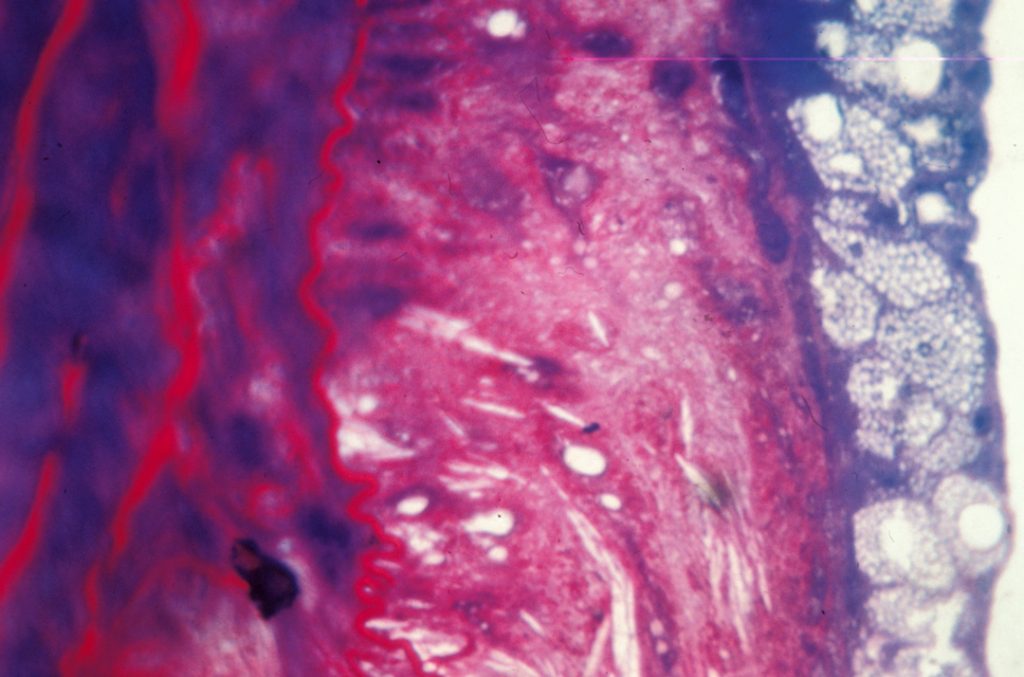
graisse sur une partie de la paroi artérielle interne. © Inserm / Centre de recherche cardiovasculaire
Liquide restant après avoir collecté le beurre lors du barattage de la crème fraîche, le babeurre est très riche en lipides polaires : de 1,5 à 9 g par litre, contre 0,4 g/l dans le lait entier.
Une nouvelle cible contre l’insuffisance cardiaque
Jessica Sabourin, Jean-Pierre Benitah. Unité 1180 Inserm / Université Paris-Saclay, Signalisation et physiopathologie cardiovasculaire
En France, on dénombre environ un demi-million de personnes qui souffrent d’insuffisance cardiaque. Une pathologie commune, qui nécessite de bien comprendre les mécanismes cellulaires en jeu. L’équipe de Jessica Sabourin et de Jean-Pierre Benitah, à l’université Paris-Saclay, a découvert le rôle clé d’une protéine, Orai1, que l’on retrouve dans la composition de certains canaux calciques – porte d’entrée des ions calcium dans la cellule – et qui participe à l’équilibre ionique des cellules. Chez des sujets en bonne santé, cette protéine ne semble pas tenir un rôle majeur au niveau du cœur. Des expériences menées sur des souris transgéniques, chez qui Orai1 est inactivée pour cet organe, le montrent : la fonction cardiaque des souris était normale. En revanche, chez des souris qui souffrent d’insuffisance cardiaque, les chercheurs ont noté une surexpression d’Orai1. Mieux, l’inhibition de la protéine permettait de corriger la maladie ! Orai1 aurait donc un rôle important pour la fonction cardiaque dans des situations pathologiques, et se révèle une cible thérapeutique
prometteuse.
En dehors du cœur, la protéine Orai1 est très impliquée dans le système
immunitaire. Son inhibition peut causer une immunodéficience sévère.
Les plaquettes n’assurent plus
Sonia Severin. Unité 1048 Inserm / Université Toulouse III Paul-Sabatier
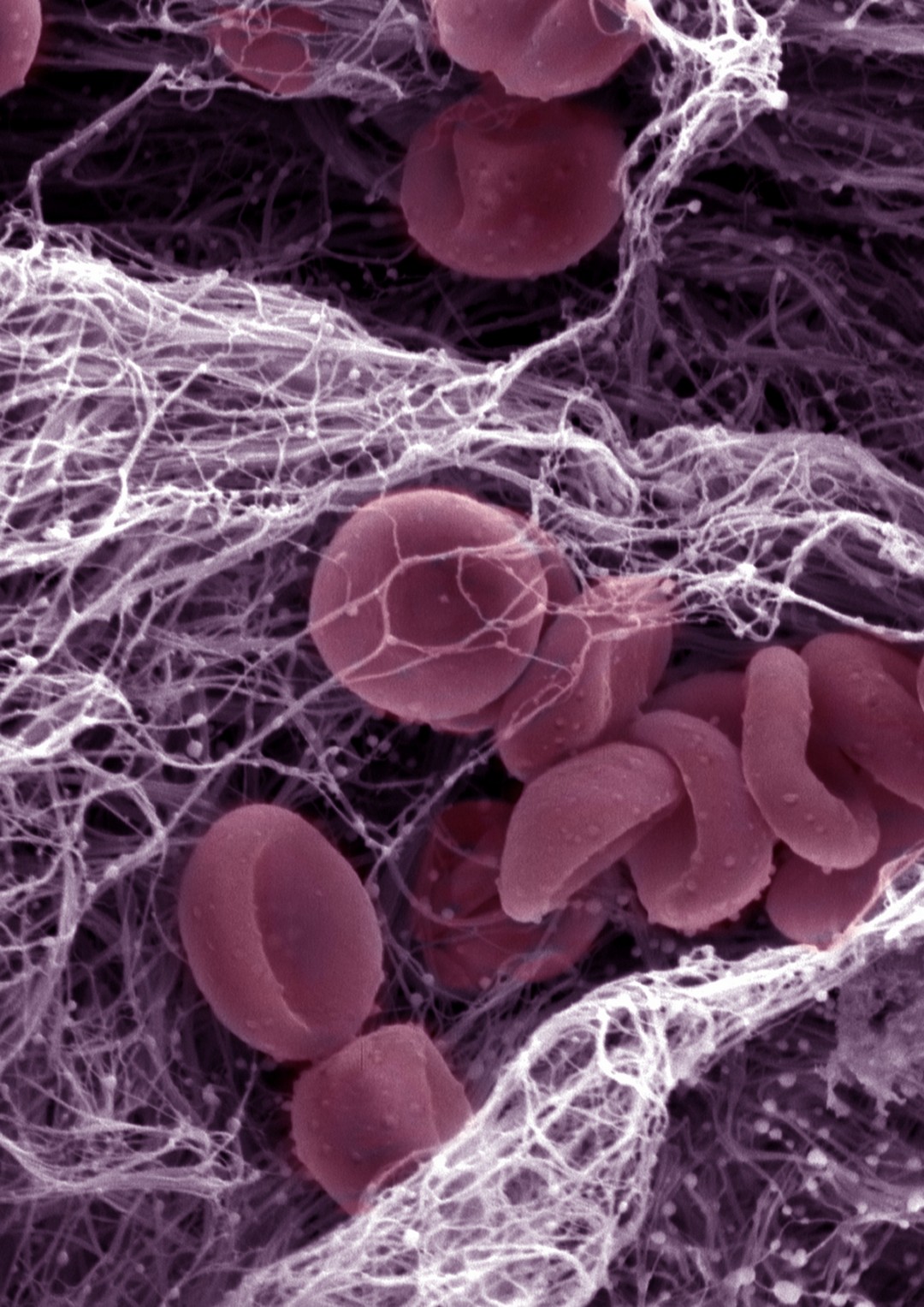
Le syndrome de Noonan est une maladie génétique qui concerne une naissance sur 1000 à 2500. Il se traduit par une variété de symptômes : traits du visage caractéristiques, petite taille, malformations cardiaques… De plus, la moitié des patients environ présentent des troubles hémorragiques. Les travaux de Sonia Severin et de son équipe, à l’Institut des maladies métaboliques et cardiovasculaires de Toulouse, apportent de nouveaux éléments sur les mécanismes sous-jacents à ces saignements. Des expériences menées sur des souris modèles de la pathologie et des échantillons sanguins de patients montrent que des mutations du gène PTPN11 perturbent la signalisation des plaquettes sanguines nécessaire à leur activation. Ainsi, lors d’une blessure vasculaire, les plaquettes, censées s’agréger pour empêcher le saignement en formant un thrombus, ne le font pas efficacement, ce qui contribue aux troubles hémorragiques. Ces résultats vont améliorer la prise en charge des patients.
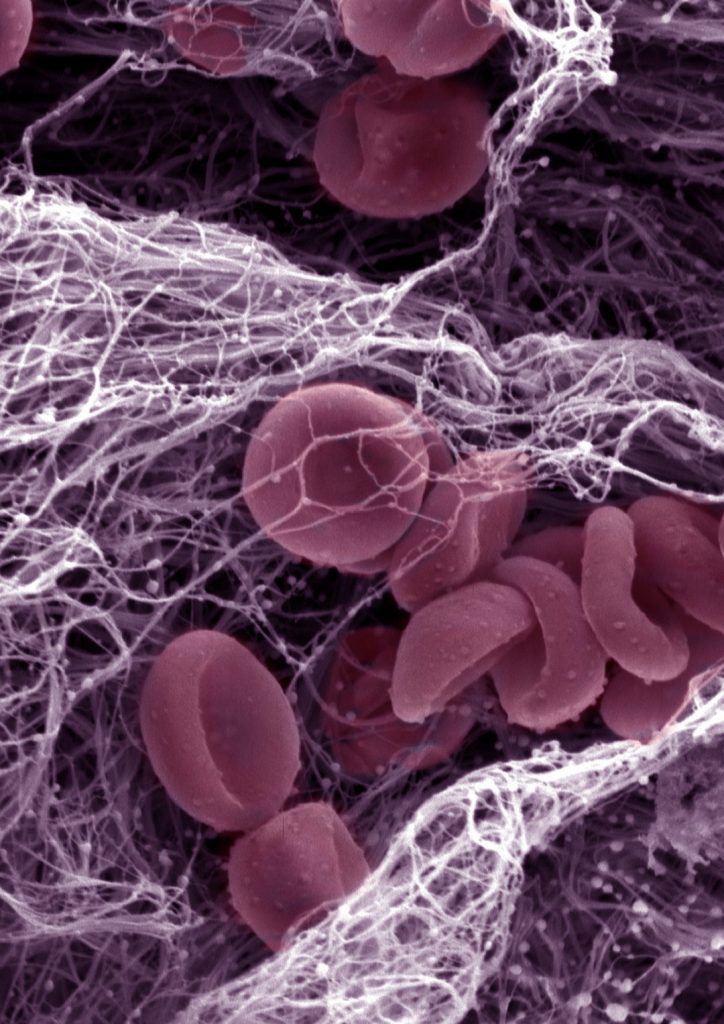
Le gène PTPN11 est muté dans la moitié des cas de syndrome de Noonan, et systématiquement si des saignements anormaux sont liés.
Battre le fer ?
Raphaël Rodriguez. Unité 1143 Inserm / Institut Curie / CNRS, Chimie et biologie de la cellule
Longtemps étudiée pour son implication dans des processus
biologiques variés, comme le développement embryonnaire, la réponse immunitaire ou encore la progression tumorale, la molécule CD44 vient de révéler de nouveaux secrets à l’équipe de Raphaël Rodriguez, de l’institut Curie à Paris. La glycoprotéine, qui se trouve à la surface des cellules de nombreux organes, leur permettrait d’absorber le fer, un élément indispensable au corps humain. Une fois à l’intérieur des cellules, le fer transmis par CD44 est capable de déverrouiller l’expression de certains gènes, en agissant sur des histones qui maintiennent l’ADN compacté et sous contrôle. C’est hélas une bonne nouvelle pour les cellules cancéreuses : le fer approvisionne les mitochondries pour qu’elles produisent des métabolites essentiels à la formation des métastases. Il libère également des gènes nécessaires à la prolifération du cancer. Dans ce contexte, CD44 devient même la principale porte d’entrée du fer… Les chercheurs développent déjà des molécules qui interfèrent avec le processus.
Jusqu’ici, les biologistes pensaient qu’un seul mécanisme permettait l’internalisation du fer par les cellules, impliquant la transferrine et son récepteur TfR1.
Membrane en option
Marcelo Nollmann. Unité 1054 Inserm / CNRS / Université de Montpellier
L’organisation, c’est avant tout du classement et du tri. Afin de séparer, concentrer et localiser certaines réactions biochimiques, les cellules compartimentent leurs composants – les organites – à l’intérieur de membranes… mais pas seulement. On sait depuis peu qu’une manière de faire plus originale et plus flexible existe : la séparation de phases.
Ce phénomène chimique s’observe dans la vie de tous les jours, par exemple lorsque deux liquides comme l’eau et l’huile sont dans l’impossibilité de se mélanger. Des gouttelettes ou condensats se forment alors ! Mais pour les cellules, il ne suffit pas de créer ces « espaces de rangement » grâce à la séparation de phases, il faut aussi les organiser dans l’espace sous-cellulaire. En utilisant des techniques de microscopie de fluorescence avancées, Marcelo Nollmann et son équipe du Centre de biochimie structurale et de l’université de Montpellier montrent que de petits moteurs moléculaires énergétiques sont capables de séparer, véhiculer, diviser, déplacer et positionner des condensats transportant du matériel génétique à l’intérieur de cellules bactériennes, ceci afin d’assurer leur transmission lors de la division cellulaire.
Un organite est une petite structure spécialisée contenue dans la cellule. Les différents organites possèdent chacun une fonction distincte, et travaillent en coopération.
La SAGA de l’expression génétique
Patrick Schultz. Unité 1258 Inserm / CNRS / Université de Strasbourg.

Tout le matériel génétique n’est pas utilisé simultanément. En réalité, l’expression des gènes est continuellement modulée, et l’essentiel du génome demeure silencieux, conditionné hermétiquement sous forme de chromatine. Pour qu’un gène puisse être utilisé, la chromatine doit se décompacter et un complexe d’initiation doit être assemblé en amont du segment d’ADN qui sera utilisé : c’est le rôle du complexe SAGA. Pour mieux comprendre ce dernier, Patrick Schultz et son équipe de l’Institut de génétique et de biologie moléculaire et cellulaire à l’université de Strasbourg ont étudié sa structure atomique par cryomicroscopie électronique. Composé de 19 protéines, SAGA fait le lien entre l’organisation du génome et les signaux cellulaires qui stimulent la synthèse des protéines. Le complexe modifie les histones, qui maintiennent la chromatine bien compacte, et dépose de manière contrôlée la protéine TBP chargée d’amorcer l’assemblage de la machinerie de transcription. L’organisation spatiale de SAGA nous renseigne sur ses fonctions biologiques et sur les mécanismes qui régulent l’interaction de TBP avec l’ADN. Ces recherches expliquent de nombreuses observations antérieures sur le rôle des sous-unités de SAGA, et établit un nouveau paradigme pour la régulation de la fonction de TBP.
La transcription est la première étape de l’expression génique, au cours de laquelle un segment particulier d’ADN est « copié » en ARN messager.
Des origines moléculaires de la virulence bactérienne
Axel Innis. Unité 1212 Inserm / CNRS / Université de Bordeaux, ARN : régulations naturelle et artificielle.
Pour survivre et se multiplier dans un organisme hôte, les bactéries pathogènes doivent s’adapter – par exemple en ajustant l’expression et l’activité de certaines enzymes. En particulier, celles qui produisent des polyamines, ces métabolites qui jouent un rôle important dans l’expression génétique, la croissance cellulaire, l’adaptation au stress
ou encore la virulence chez les bactéries. En s’intéressant à la
production de ces molécules, Axel Innis et son équipe du laboratoire Arna, à l’Institut européen de chimie et biologie à l’université de Bordeaux, ont révélé que pour synthétiser certaines polyamines dans les protéobactéries, le ribosome – la machine qui construit les protéines – doit capturer l’acide aminé ornithine à l’aide d’un peptide qui reconnaît la molécule. En plus d’améliorer la compréhension du fonctionnement du ribosome, cette découverte pourrait expliquer comment l’ornithine favorise la virulence chez plusieurs agents
pathogènes humains.
Malgré des études exhaustives sur les polyamines, leur fonction biochimique précise demeure l’un des grands mystères de la biologie cellulaire et moléculaire.
La semaine prochaine : « Cancer et santé publique ». Rendez-vous pour huit nouveaux faits scientifiques marquants de 2020 !
Retrouvez toutes les avancées scientifiques du rapport d’activité 2020 de l’Inserm :