Un composé unique contre des pathogènes multiples
Ludger Johannes, Unité 1143 Inserm / Institut Curie / CNRS, Chimie et biologie de la cellule
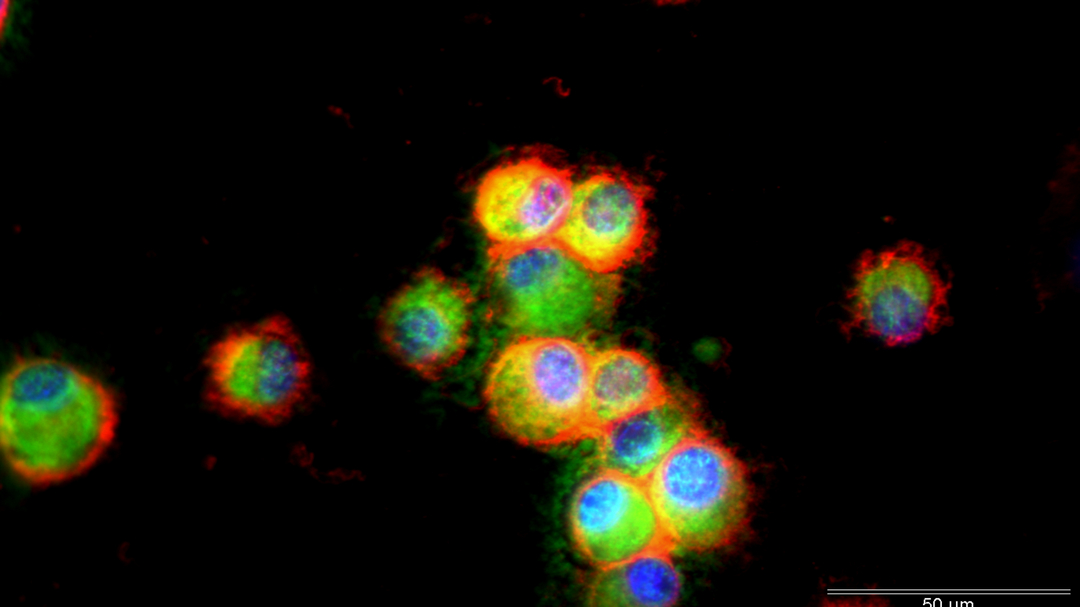
produite par E. coli. © S. Schulle
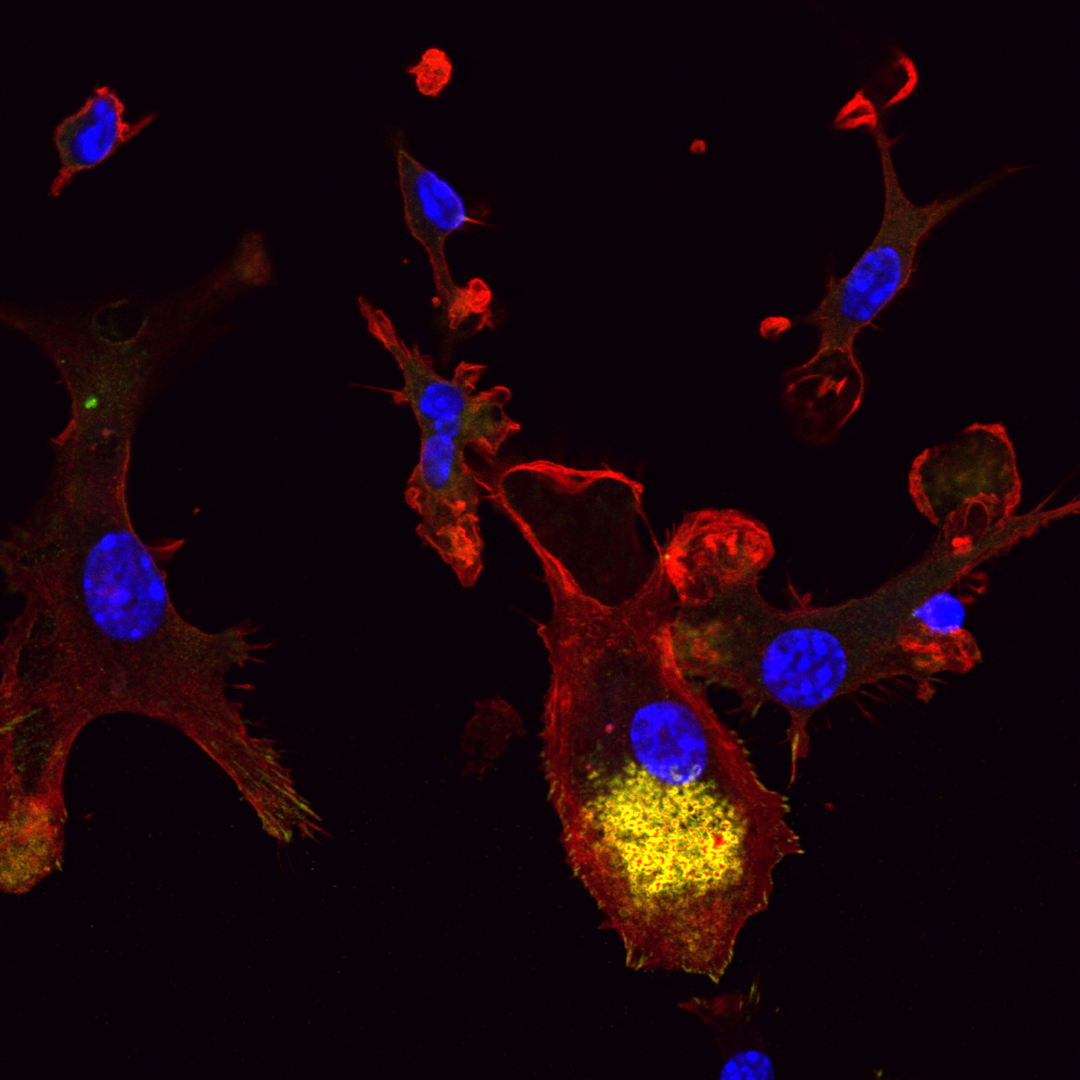
Depuis 2012, des chercheurs, dont Ludger Johannes de l’institut Curie à Paris, développent un candidat médicament qui promet un large spectre d’applications : Retro‑2. Lors de tests sur des cellules en culture, et chez la souris, celui-ci s’est avéré efficace contre plusieurs agents pathogènes potentiellement mortels : toxines des bactéries S. dysenteriae et E. coli entérohémorragiques, du choléra et de la plante ricin, parasite leishmania, entérovirus 71, et quelques autres. En utilisant deux puissantes techniques d’analyse chimique (chimie clic bio-orthogonale et spectrométrie de masse), l’équipe vient de découvrir que Retro‑2 agit en se fixant sur la protéine cellulaire Sec16A. Ainsi, il empêche la circulation intracellulaire de la protéine Syn5, nécessaire à la progression dans la cellule des toxines et pathogènes cités plus haut. Reste maintenant à vérifier l’efficacité de Retro‑2 chez des animaux plus proches de l’Homme, comme le porc, avant de passer aux tests chez l’humain.
Retro‑2 empêche le processus de transport rétrograde, qui permet de véhiculer des éléments de l’extérieur vers l’intérieur de la cellule, contrairement au transport antérograde, orienté dans le sens inverse.
Comment les cellules mesurent leur propre taille
Yohanns Bellaïche Unité 934 Inserm / CNRS / Sorbonne Université / Institut Curie, Génétique et biologie du développement
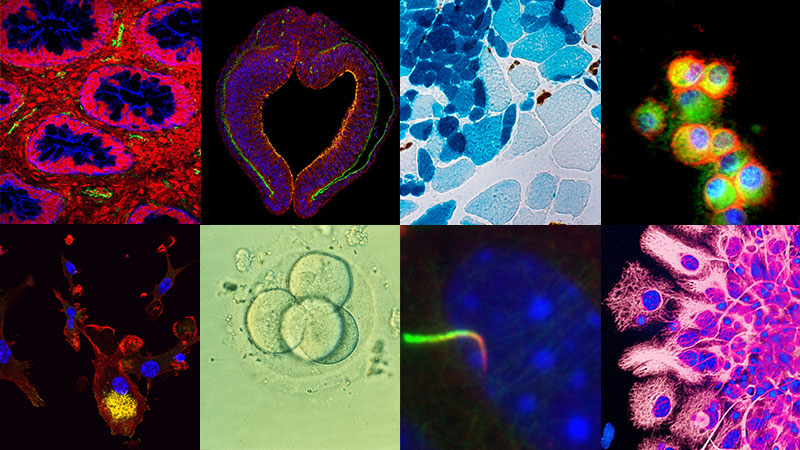
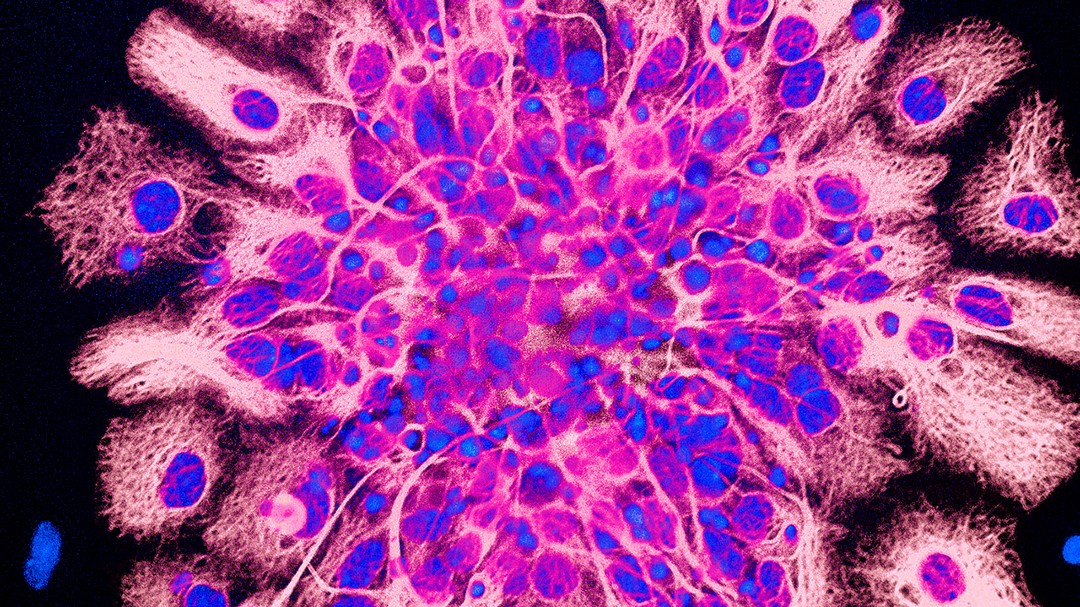
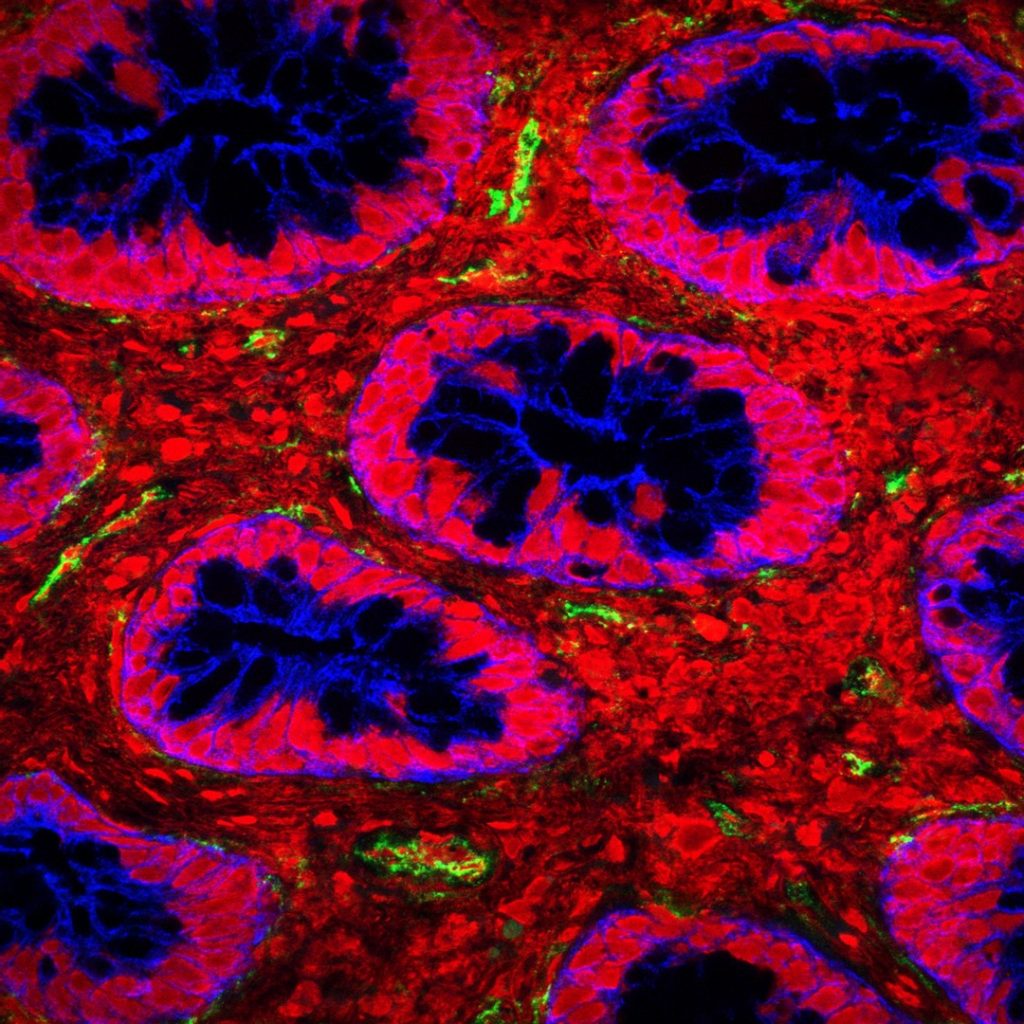
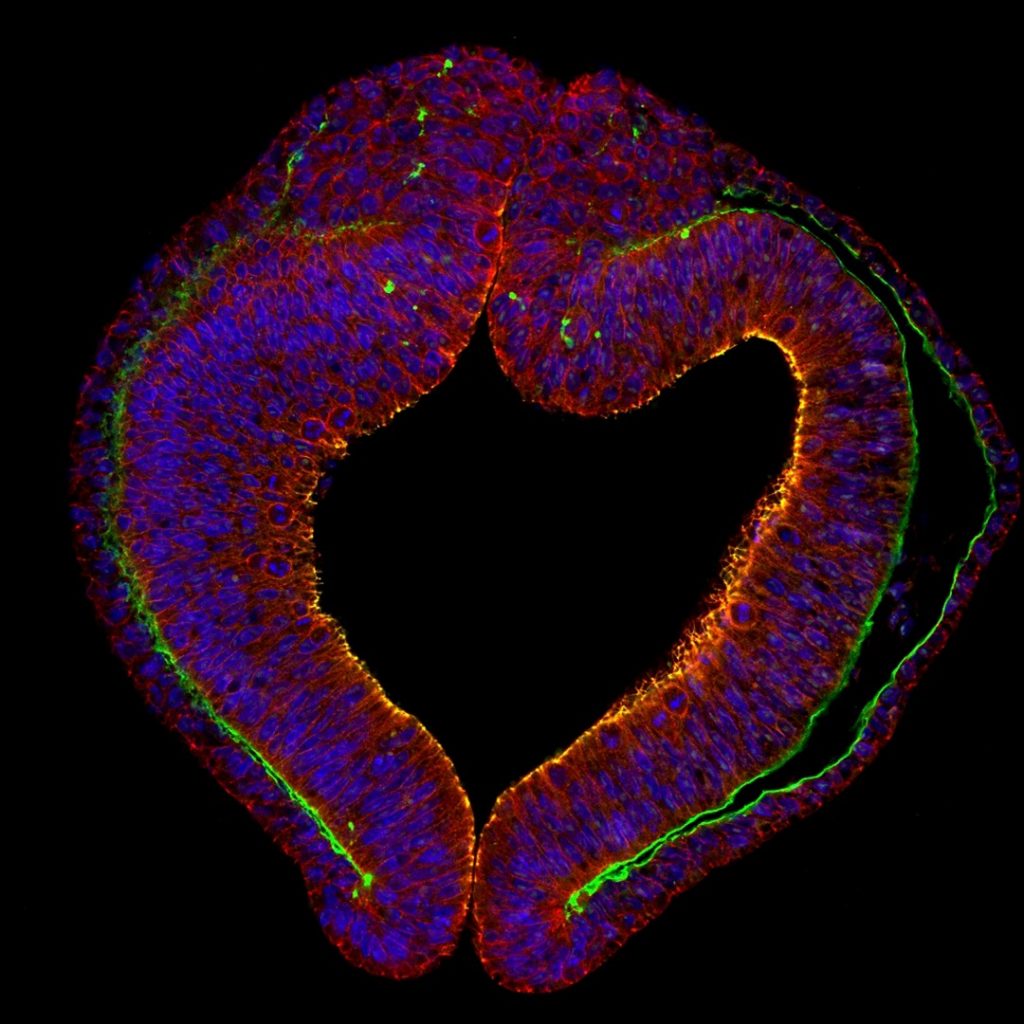
Lors du développement des organes, ou morphogenèse, les tissus épithéliaux qui recouvrent la peau, ainsi que la paroi interne de certains organes (estomac, intestin…) et cavités (buccale, utérine…), subissent de fortes tensions mécaniques. Pour comprendre comment les cellules épithéliales y résistent, une équipe dirigée par Yohanns Bellaïche, à l’institut Curie de Paris, a examiné les effets de ces forces sur l’épithélium du thorax dorsal de la nymphe de drosophile. Les chercheurs ont découvert que les contraintes morphogénétiques stimulent la formation de nouvelles structures, extensibles, ancrées au pôle cellulaire apical – c’est-à-dire l’extrémité cellulaire tournée vers le milieu extérieur. Ces structures, ce sont les fibres de stress apicales. Leur nombre augmente quand la surface cellulaire apicale croît, pour limiter l’étirement des cellules et favoriser la prolifération cellulaire. On comprend mieux, désormais, comment les cellules « mesurent » leur taille lors de la croissance des organes, pour résister aux forces d’étirement et adapter leur prolifération.
poussin. La membrane cellulaire des cellules épithéliales individuelles est visible, ainsi que leur apex (en rouge). © Anneliese Norris
Formés de cellules étroitement juxtaposées et solidarisées par des systèmes de jonction, les tissus épithéliaux sont l’un des 4 types tissulaires principaux de notre corps, avec les tissus musculaires, nerveux et conjonctifs.
L’écoulement urinaire augmente la production d’énergie
Patrice Codogno, Nicolas Dupont Unité 1151 Inserm / CNRS / Université de Paris
Les cellules épithéliales du rein, ou KEC (pour kidney epithelial cells), sont de grandes consommatrices d’adénosine triphosphate (ATP), une molécule clé pour fournir les cellules en énergie. Selon une étude menée par Patrice Codogno, Nicolas Dupont et deux autres équipes de l’institut Necker-Enfants malades à Paris, la pression générée par l’écoulement du flux urinaire au niveau des KEC contribue à augmenter la production d’ATP de ces cellules. Après analyse de KEC en culture et chez des souris chez lesquelles le flux urinaire est interrompu, il est apparu que cette pression, captée par les cils primaires (des prolongements cellulaires mobiles) des KEC, enclenche deux cascades de réactions biochimiques. L’une augmente le nombre de mitochondries, les compartiments cellulaires producteurs d’ATP. L’autre stimule le processus de lipophagie, qui dégrade les lipides en acides gras utilisables pour fabriquer de l’ATP, d’où une augmentation de sa production. Voilà une fonction du flux urinaire pour le moins inattendue !
Le rein est le deuxième organe de notre corps le plus exigeant en énergie, après le cœur. De tous les types de cellules rénales, les cellules épithéliales proximales sont les plus énergivores.
Ne jetez pas, réparez !
Gaëtan Juban, Rémi Mounier Unité 1217 Inserm / CNRS / Université de Lyon
Les macrophages sont des cellules immunitaires cruciales pour la réparation des tissus. Lors de ce processus, interviennent d’abord des macrophages de type pro-inflammatoire capables d’éliminer les cellules abîmées. Puis, ces cellules changent de phénotype et deviennent des macrophages anti-inflammatoires, aptes à stimuler la régénération des tissus. Des travaux chez des souris génétiquement modifiées, dirigés par Gaëtan Juban et Rémi Mounier de l’institut NeuroMyoGène à Lyon, ont permis d’identifier le déclencheur de cette conversion des macrophages : la protéine annexine A1 (ANXA1) secrétée par certains globules blancs, les neutrophiles. Des expériences sur des macrophages humains ont révélé que ANXA1 agit en se fixant sur son récepteur FPR2 ; cela stimule la protéine AMPK, qui en retour active des réactions moléculaires permettant la conversion des macrophages. Ces résultats pourraient aider à mieux traiter les pathologies liées à une inflammation chronique, comme l’arthrite.
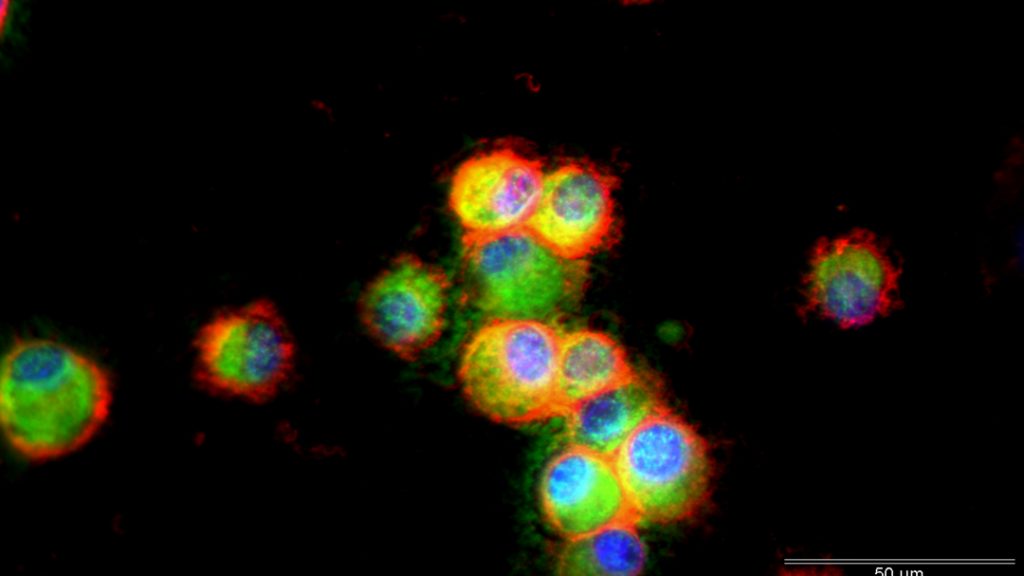
Le phénotype d’une cellule correspond à l’ensemble de ses caractéristiques. Il dépend de l’expression des gènes (génotype) et se caractérise par exemple par une production plus élevée de certaines protéines plutôt que d’autres.
Sous l’influence de père et mère
Edith Heard, Katia Ancelin Unité 934 Inserm / Université Pierre-et-Marie-Curie
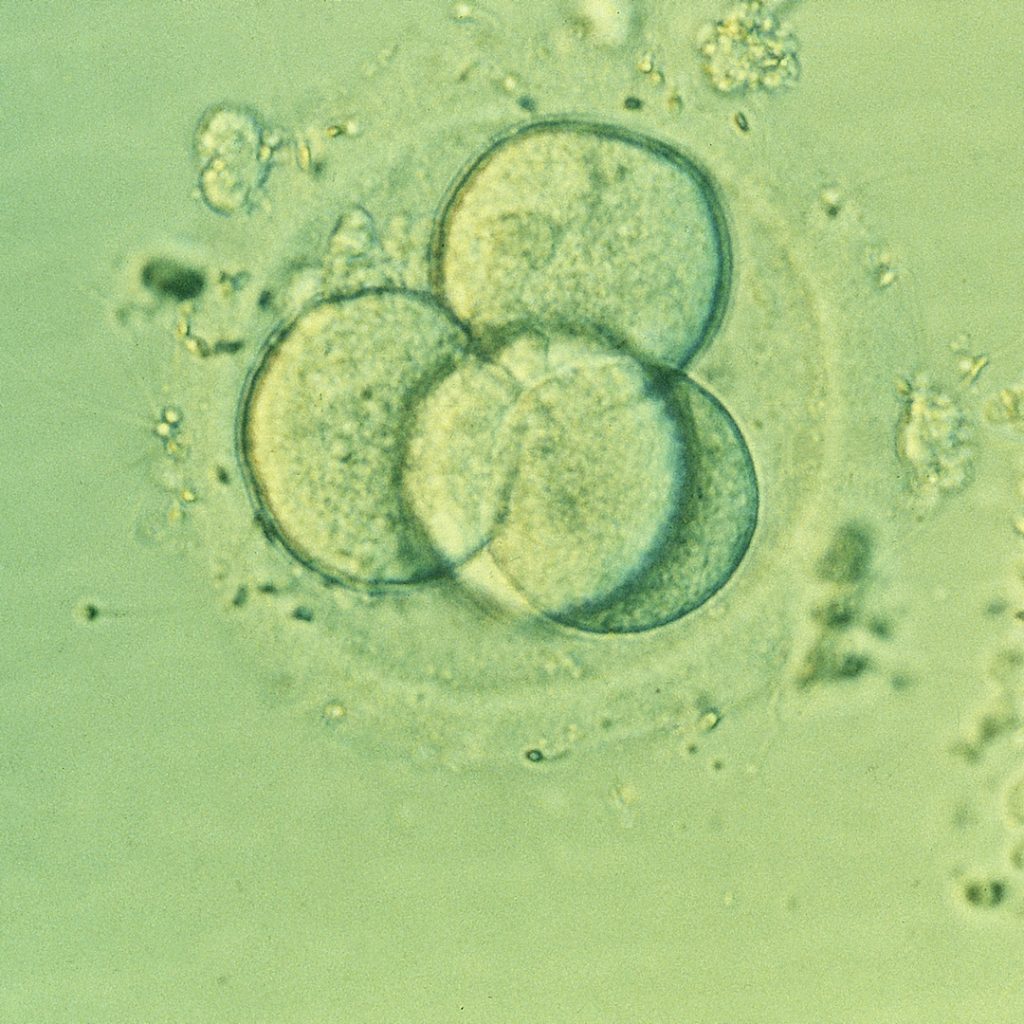
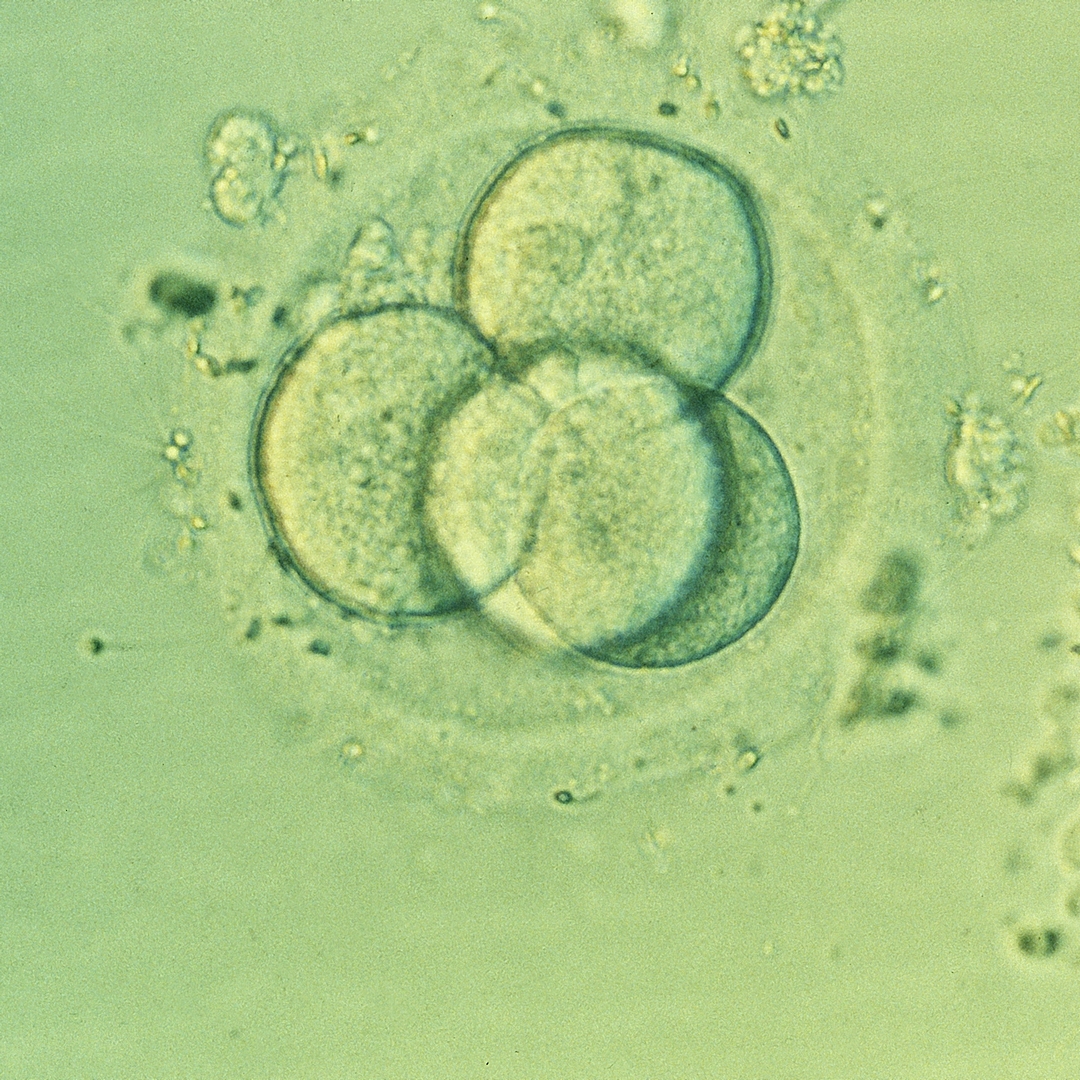
fécondation. © Inserm/Bruno Lassalle
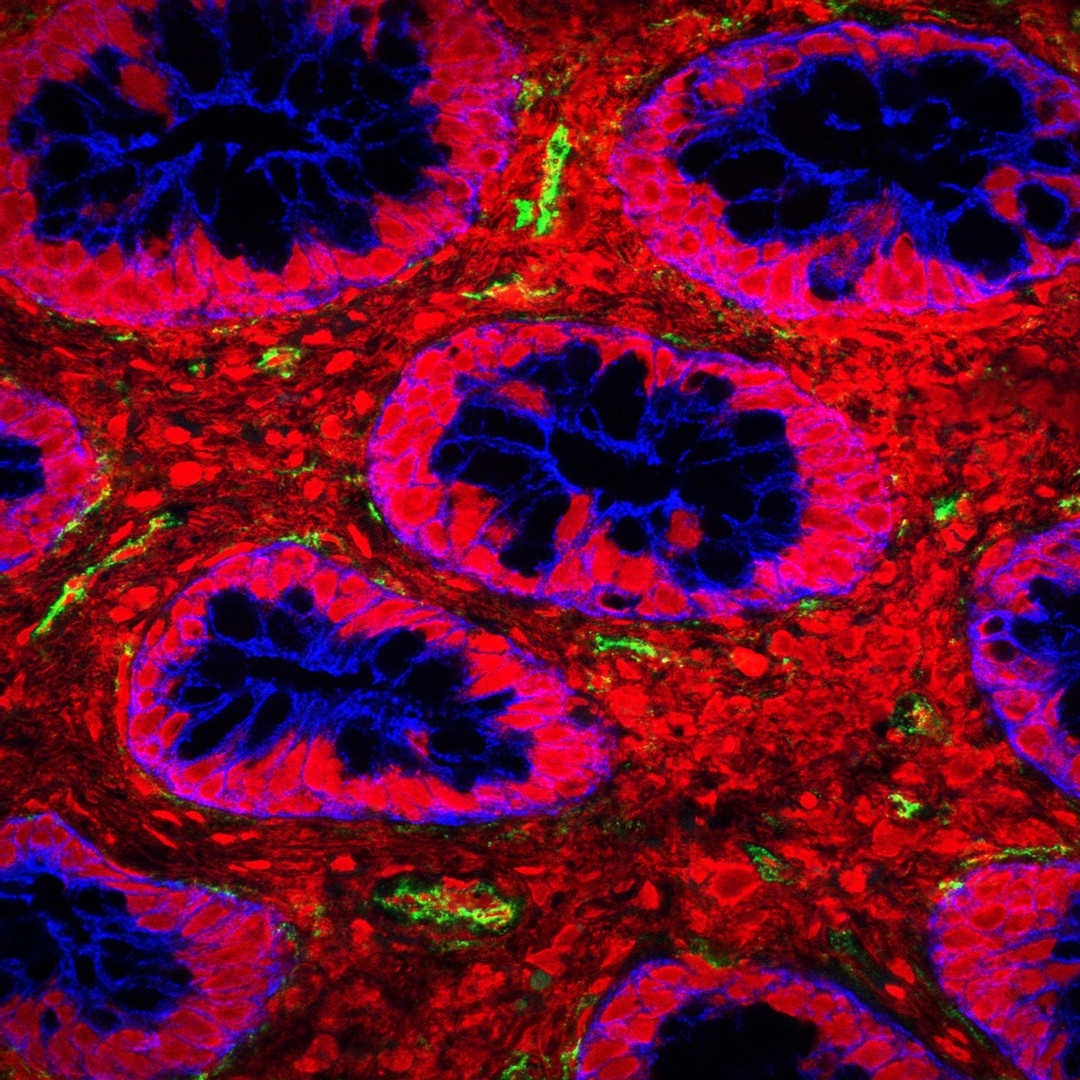
L’expression des gènes suit une dynamique complexe, surtout au cours du développement embryonnaire. L’équipe d’Edith Heard, Grand Prix Inserm 2017, et de Katia Ancelin à l’institut Curie à Paris a participé à des travaux sur des souris qui mettent en lumière la façon dont les gènes sont exprimés dans les premières heures qui suivent la fécondation, grâce à la technique Hi‑C. Lorsque l’embryon ne contient qu’une, deux ou quatre cellules, quelques boucles sont présentes le long de l’ADN, à certains points précis du génome. Mais certains de ces replis sont localisés sur une seule copie du chromosome – en majorité, celle de la mère – et correspondent à un phénomène de répression de gènes. Ce sont donc les autres copies qui sont exprimées – celles du père. Cette asymétrie prend fin au stade huit cellules : de nouvelles boucles apparaissent alors et un schéma plus classique d’expression des gènes – à partir des deux génomes parentaux – se met en place. Ce phénomène pourrait avoir un rôle dans le dosage précis de certains gènes impliqués dans l’embryogenèse.
Le Hi‑C est une méthode de capture de conformation des chromosomes qui permet de révéler les boucles du filament d’ADN d’un chromosome.
Laissez entrer le virus
Federico Mingozzi Unité 951 Inserm / Université d’Évry, Approches génétiques intégrées et nouvelles thérapies pour les maladies rares
Sébastien Lacroix-Desmazes Unité 1138 Inserm / Sorbonne Université / Université de Paris
En thérapie génique, pour apporter le gène thérapeutique aux cellules cibles, on utilise notamment des virus de type AAV, c’est-à-dire un petit virus à ADN non pathogène. Il est cependant impossible de traiter les personnes qui possèdent des anticorps anti-AAV, ceux-ci risquant de bloquer le vecteur viral avant qu’il n’atteigne son but. L’équipe de Federico Mingozzi de Généthon à Évry et Spark Therapeutics et celle de Sébastien Lacroix-Desmazes du centre de recherche des Cordeliers à Paris viennent de trouver la parade : l’enzyme IdeS (imlifidase) qui neutralise les anticorps anti-AAV. Les chercheurs l’ont injectée à des souris qui avaient reçu des anticorps anti-AAV humains et à des primates non humains naturellement immunisés contre ces virus. Ils leur ont ensuite administré un vecteur AAV porteur d’un gène rapporteur, c’est-à-dire à l’activité observable. Dans les deux cas, leur taux d’anticorps a diminué et, surtout, le gène s’est exprimé normalement. Grâce à IdeS, la thérapie génique pourrait donc être proposée à un plus grand nombre de malades, y compris à ceux qui en ont déjà reçu une, et ce d’autant plus vite que l’enzyme a été autorisée en août 2020 sur le marché européen pour éviter le rejet des greffes rénales.
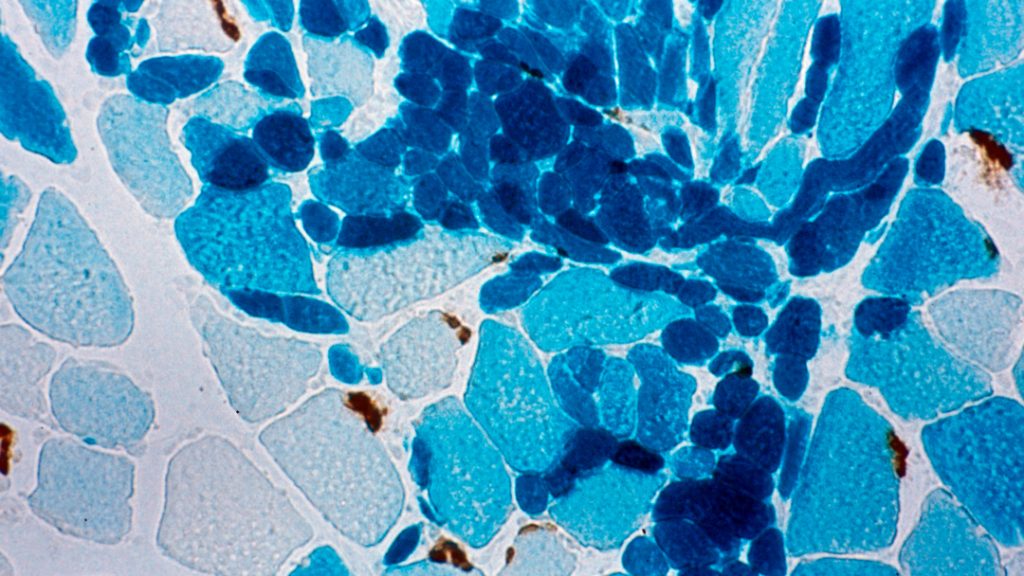
les myoblastes © Inserm / Jean-Thomas Vilquin
On estime que 30 à 50 % de la population a développé des anticorps qui bloquent les AAV, suite à l’exposition à ces virus.
Nouvelle définition pour le syndrome de Lamb-Shaffer
Christel Depienne Unité 1127 Inserm / Université Pierre-et-Marie-Curie
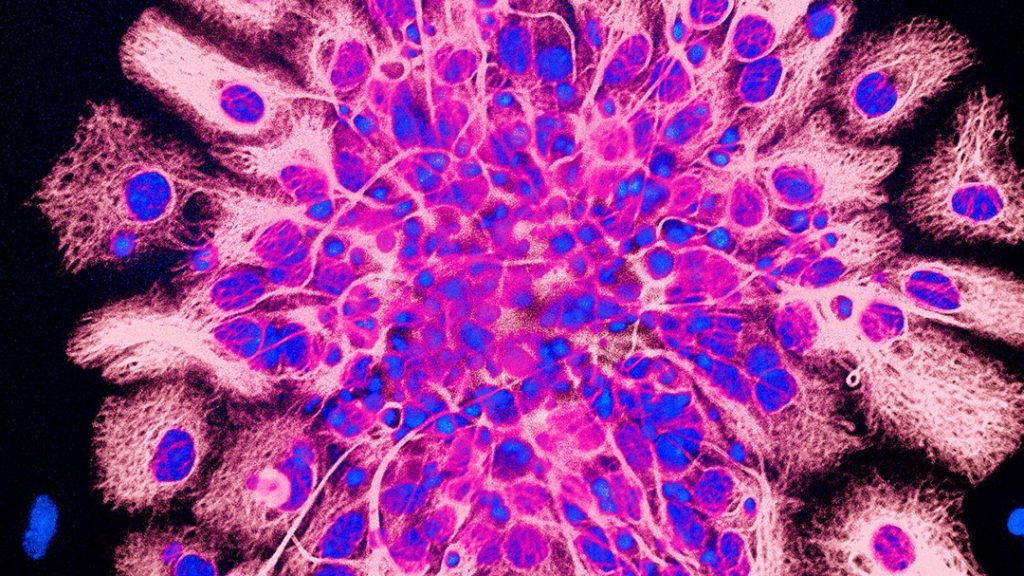
Le syndrome de Lamb-Shaffer est une maladie génétique rare : on dénombrait récemment moins d’une trentaine de cas dans le monde. Des travaux internationaux codirigés par Christel Depienne, de l’Institut du cerveau à Paris, ont permis d’étendre le tableau clinique et génétique de cette maladie, et de recenser une quarantaine de nouveaux patients. Le syndrome est associé à des pertes de matériel génétique sur le gène SOX5, indispensable au développement embryonnaire et à la différenciation des neurones. Les signes cliniques sont multiples et incluent notamment un retard du développement et du langage, une malformation de la mâchoire, une scoliose, ou encore des troubles de la fonction motrice fine. En collaboration avec d’autres équipes internationales, les auteurs ont identifié des patients porteurs des mutations ponctuelles du gène qui provoquent l’interruption de sa séquence codante ou de sa capacité à remplir ses fonctions. Cette nouvelle définition génétique et clinique permettra de mieux identifier les patients à l’avenir.
Une seule copie de l’allèle du gène SOX5 défectueuse suffit à provoquer le syndrome de Lamb-Shaffer. La copie saine ne produit pas assez de protéines fonctionnelles pour compenser : on parle alors d’haploinsuffisance.
Place à la thérapie génique de masse
Mario Amendola Unité 951 Inserm / Université d’Evry / Université Paris-Saclay
Votre téléphone est cassé. Vous l’apportez au réparateur, qui identifie la panne et la corrige. Un processus certes écologique mais très fastidieux, surtout à grande échelle. Une autre stratégie consisterait à vous donner un téléphone neuf, issu d’une usine hyper-productive. C’est l’option choisie par Mario Amendola et son équipe au Généthon à Évry : l’approche de masse plutôt que le sur-mesure, appliquée à la thérapie génique. Au lieu de réparer le gène défectueux chez chaque patient concerné par le traitement, les chercheurs ont utilisé des ciseaux génétiques (CRISPR-Cas9) afin d’insérer ex vivo un gène sain dans un site à haute production : c’est-à-dire au sein du génome de futures cellules sanguines, qui ont pour caractéristique de se multiplier beaucoup. Le gène est placé à l’endroit précis où une protéine, l’hémoglobine alpha, est produite en grande quantité. Cette dernière, défectueuse chez les malades, peut ainsi être synthétisée « à l’échelle industrielle ». Cette stratégie, qui nécessite d’être testée en clinique, pourrait trouver des applications pour diverses maladies génétiques.
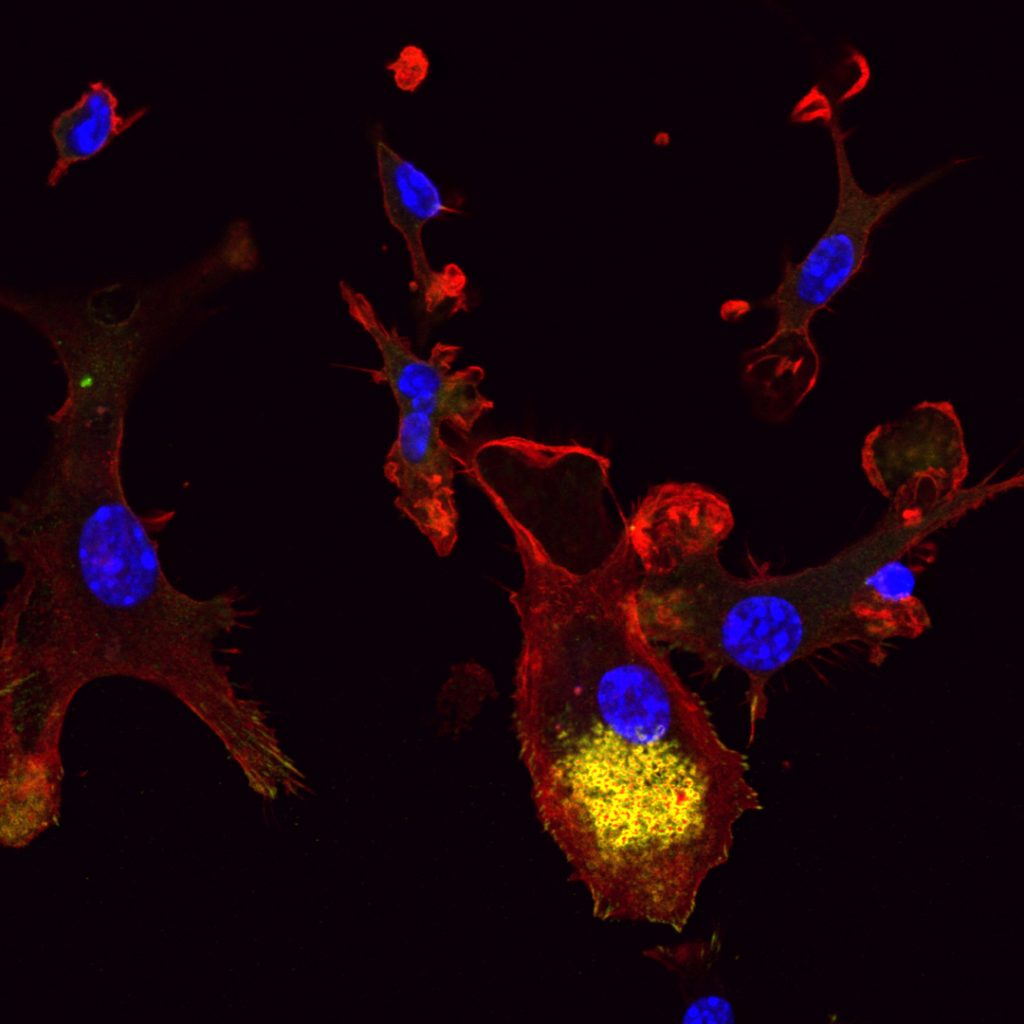
Plusieurs maladies génétiques ont été étudiées dans ces travaux, dont en premier lieu la maladie de Wolman, causée par le déficit d’une enzyme et qui touche une naissance sur 100000.