Quel est votre parcours ?
J’ai commencé mes études en intégrant l’ESIL qui est une école d’ingénieur avec un volet industriel/biotechnologie et un volet de recherche en biologie cellulaire. A l’issu de ce diplôme je suis directement entré à l’Institut Gustave Roussy. J’y ai fait une thèse pendant 3 ans sur le cancer du nasopharynx puis un premier post-doc dans l’équipe de Jean-Charles Soria. J’ai ensuite réalisé un second post-doc aux Etats-Unis, c’est là que j’ai découvert ma thématique actuelle des thérapies ciblées. Lorsque je suis revenu en France en 2015 j’ai réintégré l’Institut Gustave Roussy, Jean-Charles Soria m’a alors confié l’animation de son équipe de recherche ce qui m’a permis de me présenter au concours de l’Inserm en 2018.
Quelle est votre thématique de recherche aujourd’hui ?
Ma thématique de recherche est l’étude des mécanismes de résistance aux thérapies ciblées. Depuis 2010, des altérations génétiques ont été identifiées comme précurseurs de cancers. On a découvert qu’une mutation au niveau de certains gènes spécifiques était un événement initiateur du cancer, ces gènes sont appelés « drivers oncogéniques ». Si on cible ces derniers avec une thérapie ciblée dans le but d’inhiber leur activité, on obtient une très bonne réponse de la plupart des patients tout en ayant une toxicité largement diminuée par rapport à la chimiothérapie traditionnelle.

Par exemple un patient atteint d’un cancer du poumon va avoir dans 15% des cas une mutation d’un gène spécifique (EGFR). Aujourd’hui on peut inhiber ce récepteur et provoquer la mort des cellules cancéreuses. C’est le cancer avec le plus de driver oncogéniques connus, les 2/3 des patients peuvent bénéficier d’une thérapie ciblée. Cependant dans la totalité des cas, certaines cellules cancéreuses vont muter une nouvelle fois en développant une résistance à la thérapie utilisée.
J’ai commencé mes études en intégrant l’ESIL qui est une école d’ingénieur avec un volet industriel/biotechnologie et un volet de recherche en biologie cellulaire. A l’issu de ce diplôme je suis directement entré à l’Institut Gustave Roussy. J’y ai fait une thèse pendant 3 ans sur le cancer du nasopharynx puis un premier post-doc dans l’équipe de Jean-Charles Soria. J’ai ensuite réalisé un second post-doc aux Etats-Unis, c’est là que j’ai découvert ma thématique actuelle des thérapies ciblées. Lorsque je suis revenu en France en 2015 j’ai réintégré l’Institut Gustave Roussy, Jean-Charles Soria m’a alors confié l’animation de son équipe de recherche ce qui m’a permis de me présenter au concours de l’Inserm en 2018.
Mon objectif est d’identifier l’origine des résistances afin de proposer
une nouvelle thérapie ciblée
Quelle est votre thématique de recherche aujourd’hui ?
Ma thématique de recherche est l’étude des mécanismes de résistance aux thérapies ciblées. Depuis 2010, des altérations génétiques ont été identifiées comme précurseurs de cancers. On a découvert qu’une mutation au niveau de certains gènes spécifiques était un événement initiateur du cancer, ces gènes sont appelés « drivers oncogéniques ». Si on cible ces derniers avec une thérapie ciblée dans le but d’inhiber leur activité, on obtient une très bonne réponse de la plupart des patients tout en ayant une toxicité largement diminuée par rapport à la chimiothérapie traditionnelle.
Par exemple un patient atteint d’un cancer du poumon va avoir dans 15% des cas une mutation d’un gène spécifique (EGFR). Aujourd’hui on peut inhiber ce récepteur et provoquer la mort des cellules cancéreuses. C’est le cancer avec le plus de driver oncogéniques connus, les 2/3 des patients peuvent bénéficier d’une thérapie ciblée. Cependant dans la totalité des cas, certaines cellules cancéreuses vont muter une nouvelle fois en développant une résistance à la thérapie utilisée.
Nos travaux consistent donc à comprendre ce qui a changé dans les cellules cancéreuses et ce qui pourrait expliquer comment elles sont devenues résistantes. Je m’appuie sur un essai clinique exclusif de l’Institut Gustave Roussy qui nous permet de récolter des biopsies de patients avant, pendant et après la thérapie ciblée. Nous pouvons ensuite établir des modèles en laboratoire et approfondir nos analyses des mécanismes de résistance.
Une fois que les nouvelles mutations ont été repérées, on peut alors proposer un ajustement du traitement : soit une combinaison de 2 thérapies ciblées soit donner un traitement de nouvelle génération. Quoiqu’il arrive nous savons qu’au bout d’un moment une résistance au traitement apparait à nouveau.
Comment identifier les résistances à la thérapie ciblée ?
Pour rechercher la résistance on séquence le génome des cellules cancéreuses afin de déterminer s’il y a des nouvelles mutations. On constate un schéma qui se répète avec les trois mêmes types de résistance : les mutations secondaires, le même gène mute à nouveau ; les voies alternatives, une autre kinase se retrouve activée et compense l’inhibition de la première et enfin tous les autres cas : défaut d’induction de la mort cellulaire, changement phénotypiques, etc…
Mon objectif est donc d’identifier les drivers de résistance afin de proposer une nouvelle thérapie ciblée. Une fois que le patient ne répond plus c’est à nouveau le séquençage qui nous indique la nouvelle cible. Ensuite on peut établir un modèle et dans ce cas on valide l’hypothèse du séquençage, le médecin peut alors ajuster le traitement du patient. Les modèles établis ont 30% de taux de succès. Dans les autres cas le modèle n’a pas pris, on peut alors créer le candidat en laboratoire en modifiant génétiquement les lignées cellulaires.
Dans un second temps, nous sommes en relation avec l’industrie pharmaceutique notamment lorsqu’ils souhaitent comprendre pourquoi les cellules cancéreuses résistent spécifiquement à leurs médicaments. Ils reviennent aussi vers moi avec une nouvelle génération de thérapie ciblée, qui sont des formules améliorées ou des combinaisons intéressantes. Ils nous demandent alors si nous avons à disposition des modèles préétablis pour renforcer leurs données sur l’inhibiteur avant de commencer les essais cliniques.
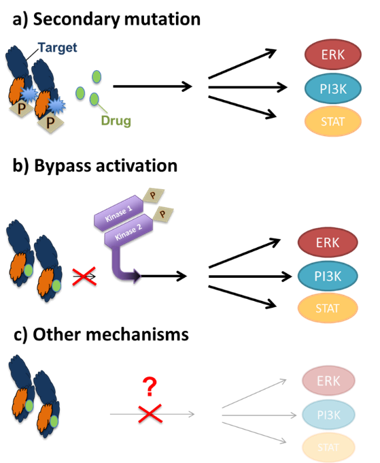
© Inserm/Friboulet, Luc/U981
Mécanismes de résistance aux inhibiteurs de la kinase :
«sur la cible » : a) mutation secondaire dans la cible elle-même
«hors cible » : b) activation de la signalisation de contournement ou
c) changements phénotypiques et épigénomiques
Comment fonctionne la thérapie ciblée ?
La thérapie ciblée consiste à apporter un inhibiteur dans les cellules. Il va spécifiquement bloquer la protéine codée par le driver oncogénique, il s’agit en général de kinases (protéines permettant la phosphorylation de résidus, impliquées dans de nombreuse voies signalétiques). Les kinases issues de driver oncogéniques vont conférer certains avantages prolifératifs aux cellules cancéreuses.
L’un des obstacles que l’on rencontre est que certains inhibiteurs de kinase ne font aucune distinction entre les protéines mutées et les autres. Ceci peut entrainer différents effets secondaires et nécessiter une prise en charge clinique. Mais même dans un tel cas le traitement reste moins lourd et invasif pour le patient que la chimiothérapie.
De plus les nouvelles générations d’inhibiteurs de kinase permettent un ciblage de plus en plus précis et bloquent plus efficacement les protéines mutées uniquement.
Aujourd’hui les inhibiteurs sont connus dans le monde entier et deviennent le traitement de premier choix même dans les pays en voie de développement. Cette thérapie a aussi comme autre avantage d’être un comprimé à prendre par voie orale et ne nécessite donc pas d’hospitalisation.
Enfin, j’ai un autre volet de ma recherche qui s’intéresse aux cellules persistantes. On débute l’analyse des cellules cancéreuses qui ne sont pas encore résistantes mais qui n’ont pas été tuées par la thérapie ciblée. Un patient recevant un traitement va avoir une très bonne réponse mais même si 90% du cancer disparait il reste toujours des résidus, et la rechute intervient dans 100% des cas. Celle-ci est dû aux mutations des cellules persistantes, siège de la résistance à la thérapie ciblée. On essaye alors d’échapper à ce scénario de réponse/rechute, la meilleure stratégie serait de pouvoir cibler ces populations. La piste principale est épigénétique, il semblerait que c’est par ces moyens que ces cellules survivent et acquièrent de nouvelles mutations permettant au cancer de se développer à nouveau.
Quel est pour vous l’avenir de la recherche en génétique ?
Je sais que l’on commence à connaitre de mieux en mieux l’ADN tumoral circulant. Il s’agit de l’ADN rejeté par les cellules cancéreuses dans la circulation. L’idée est alors de séquencer cet ADN cancéreux via une simple prise de sang. Ces dernières années de gros progrès ont été fait dans ce domaine et il est possible de séquencer et de trouver aussi vite la mutation de résistance sans ouvrir le malade, on est beaucoup moins invasifs. Il va y avoir beaucoup de développement dans les années à venir pour peut-être un jour réussir à dépister des cancers précocement via une simple prise de sang.



