Quel est votre parcours ?
Après un doctorat à Milan sur la thérapie génique pour la thalassémie, j’ai été aux Etats-Unis pour travailler sur la transcription des gènes de la globine. Après cette expérience, je suis rentrée en Italie et j’ai décidé de combiner la thérapie génique et la régulation de la transcription pour développer de nouvelles thérapies. J’ai collaboré avec le Généthon en France, avant d’intégrer l’Institut Imagine à Paris. Imagine est l’un des meilleurs centres de thérapie génique au monde. J’apprécie particulièrement le lien entre les médecins et les chercheurs, et le contact avec les patients. Je travaille aujourd’hui sur le développement de nouvelles thérapies géniques pour la thalassémie et la drépanocytose.

Comment se déroule le développement d’une thérapie génique ?
Dans notre équipe nous travaillons sur la bêta-thalassémie et la drépanocytose, deux maladies génétiques affectant l’hémoglobine, une protéine majeure des globules rouge et nécessaire au transport de l’oxygène dans l’organisme.
On commence donc par faire des recherches de bases sur les cellules, on cherche à comprendre comment l’expression des gènes de la globine fonctionne. Le but est d’identifier dans les génomes les régions importantes, on fait des analyses génomiques pour savoir quelles sont les meilleures. Une fois ces régions identifiées on peut alors développer les outils de thérapie génique.
Nous essayons d’optimiser les vecteurs viraux en utilisant
des gènes plus performants
Depuis ces dernières années notre objectif est d’optimiser les vecteurs viraux. Il s’agit de virus ayant la capacité de s’intégrer dans les génomes cellulaires. Ce sont des vaisseaux HIV, on enlève les gènes viraux et on ajoute les gènes thérapeutiques et les régions importantes pour l’expression des protéines. Il y a des patients qui réagissent mieux et d’autres qui ne réagissent pas car les cellules résistent à l’infection.
L’un des problèmes de ces vecteurs est qu’ils ne peuvent pas fournir de gènes suffisant pour produire de la globine. En effet dans le cadre de ces maladies génétiques il y a nécessité de produire beaucoup d’hémoglobine. On essaye alors d’améliorer l’expression des gènes grâce à aux études de bases. On combine enfin les études sur les patients traites déjà traités par thérapie génique et les études de recherche de base afin d’améliorer les vecteurs.
Aujourd’hui on essaye d’optimiser les vecteurs viraux en utilisant des gènes plus performants, des régions qui augmentent l’expression de l’hémoglobine, et d’autres fonctions. Une stratégie est de baisser l’expression de l’hémoglobine drépanocytaire ou des facteurs qui répriment l’expression de l’hémoglobine fœtal.
Malheureusement, même si les vecteurs peuvent introduire des gènes dans les cellules qui produisent les globules rouges on ne peut pas introduire toutes les régions importantes pour l’expression de la globine car les vecteurs sont trop petits, obtenir la même expression est extrêmement difficile.
Pour contourner ces défauts nous réfléchissons au développement d’autres approches en utilisant les outils CRISPR/Cas9. L’idée est alors de corriger directement le gène dans les cellules du patients, l’avantage c’est que tous les éléments sont déjà présents dans les cellules. L’objectif est de modifier le génome plutôt que de d’introduire de nouveaux gènes, simplement corriger la mutation, marche beaucoup mieux que les vecteurs (qui sont aussi très chers). Avec CRISPR/Cas9 il y a aussi moins de variabilité entre les patients.
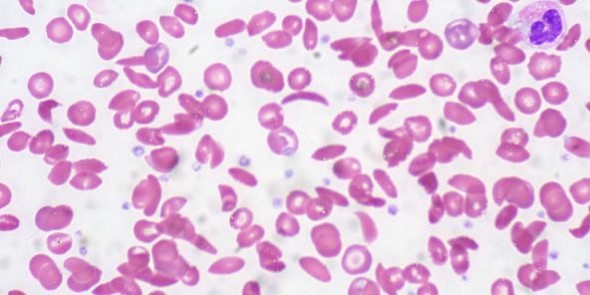
faucille. Pour cette raison, ils obstruent les petits vaisseaux provoquant des dommages aux organes.
C’est très difficile de développer des thérapies pour tous les types de mutations. Si pour la Drépanocytose il n’existe qu’une mutation pour tous les patients, dans le cas de la Thalassémie il existe plus de 300 mutations différentes, c’est donc impossible de développer seule thérapie unique. Dans ce cas on travaille avec une approche CRISPR/Cas9, le but n’est pas de corriger la mutation mais d’augmenter l’expression de l’hémoglobine fœtale (qui n’est pas touchée par la maladie). On essaye donc de développer une thérapie universelle pour tous les patients thalassémiques, en réactivant le gène exprimant la protéine fœtale.
Pour ce faire nous devons comprendre pourquoi le gène fœtal n’est plus exprimé dans les cellules adultes. C’est là que la recherche de base commence pour comprendre comment les gènes sont réprimés. On essaye d’identifier tous les facteurs et toutes les régions nécessaires pour exprimer l’hémoglobine adulte et inhiber l’hémoglobine fœtale.
Comment voyez-vous l’avenir de la recherche en génétique ?
Je pense qu’il y a encore beaucoup de chose à faire. Au cours de ces dernières années beaucoup de technologies ont été développées, on peut maintenant commencer à faire des choses que l’on n’aurait jamais pensées.
Toutes ces choses peuvent nous permettre de développer la thérapie génique ou de mettre en places des nouvelles études de bases que l’on ne pouvait pas faire avant, notamment recréer des mutations des patients en lignées cellulaire et travailler sur ces bases pour les corriger. Les nouvelles technologies vont réduire le temps de la recherche et accélérer le développement des thérapies géniques qui commencent déjà maintenant, c’est seulement le début.



