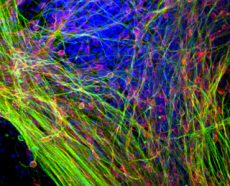
Les applications cliniques de la thérapie de remplacement cellulaire à base de cellules souches pluripotentes induites humaines (hiPSC) sont limitées notamment par le risque tumoral et l’absence de protocoles performants et standardisés de différenciation. Une étude parue dans Stem Cell Translational Medicine menée par l’équipe de Rosanna Dono, directrice de recherche Inserm à l’Institut de Biologie du Développement de Marseille (IBDM – CNRS / AMU), cible GLYPICAN‑4, une protéine associée à la membrane cellulaire et ouvre une nouvelle perspective pour générer des neurones dérivés des hiPSC, répondant aux exigences de sécurité et de qualité, mais aussi en matière de coûts, pour une application in vitro et in vivo dans la contexte de la maladie de Parkinson. Pour en savoir plus
Les cellules souches pluripotentes induites (hiPSC) humaines, qui sont obtenues par reprogrammation génétique de cellules adultes différenciées, ont un potentiel immense d’applications dans le domaine biomédical. Leur capacité à se multiplier à l’infini et, guidées in vitro par des facteurs spécifiques, à générer différents types de cellules somatiques spécialisées, est déjà largement utilisée pour modéliser de nombreuses pathologies humaines et, ainsi, d’en étudier les mécanismes ou de tester des molécules thérapeutiques. Elle ouvre également des perspectives pour la thérapie de remplacement cellulaire. L’une des applications les plus prometteuses des hiPSC en médecine régénérative, en cours d’essai clinique, est le traitement de la maladie de Parkinson (MP). Cette pathologie neurodégénérative très invalidante, est caractérisée par la perte des neurones d’une région profonde du cerveau qui utilisent la dopamine comme neurotransmetteur. La stratégie mise en œuvre repose sur la transplantation de cellules « dopaminergiques immatures », dérivées in vitro d’hiPSC et susceptibles de se développer in vivo en neurones fonctionnels, dans le striatum, l’une des zones cérébrales les plus affectées par le déficit en dopamine. L’application de cette thérapie cellulaire à un grand nombre de patients nécessite la mise en place de procédures standardisées, aisées et de faible coût permettant la production d’une population de cellules dérivées d’hiPSCs la plus homogène possible pour la transplantation, dépourvue de risque tumoral et enrichie en progéniteurs de neurones à dopamine.
Cette publication dans Stem Cell Translational Medicine identifie la protéine GLYPICAN‑4 (GPC4), exprimée dans les hiPSCs et connue pour réguler les facteurs contrôlant la différenciation, comme une cible potentielle pour améliorer la production de nouveaux neurones à dopamine à partir des hiPSCs. Ainsi, ces travaux montrent que la régulation à la baisse des taux de GPC4 dans les hiPSC favorise leur différenciation en progéniteurs des neurones à dopamine du mésencéphale qui sont préférentiellement affectés dans la MP, à la fois in vitro et après transplantation dans un modèle expérimental de la maladie chez le rat. Des études approfondies en culture cellulaire montrent en outre que la réduction des taux de GPC4 dans les hiPSC leur confère un état biologique associant le maintien de leurs propriétés d’auto-renouvellement et de pluripotence en condition souche ainsi qu’une entrée efficace dans le lignage cellulaire des neurones à dopamine du mésencéphale en condition de différenciation. Cette réduction favorise l’ensemble du processus de génération de ces neurones, depuis les stades de précurseur neuronal puis de progéniteur spécifique jusqu’à la maturation neuronale terminale. En outre, la régulation négative de GPC4 est associée à une réduction de la tumorigénicité des hiPSCs testée en condition de xénogreffe dans le flanc de souris immunodéprimée. L’approche de ciblage de la protéine GPC4 a donc le potentiel d’optimiser la qualité et la sécurité de l’utilisation des hiPSC pour la modélisation de la MP et la thérapie de remplacement cellulaire, en permettant de générer de nouveaux neurones dopaminergiques différenciés en plus grand nombre tout en atténuant le risque de tumeurs. Ils suggèrent en outre que la modulation temporelle des taux de GPC4 au cours du développement constituerait un mécanisme contribuant à la génération de neurones dopaminergiques du mésencéphale.
Contact chercheur :
Rosanna DONO
DR2 INSERM
Institut de Biologie du Développement de Marseille
E‑mail : rosanna.dono@univ-amu.fr
Tél. +33 4 91 26 92 66