Vous travaillez sur les maladies héréditaires de l’œil responsables de cécité, et focalisez votre attention sur la rétine.
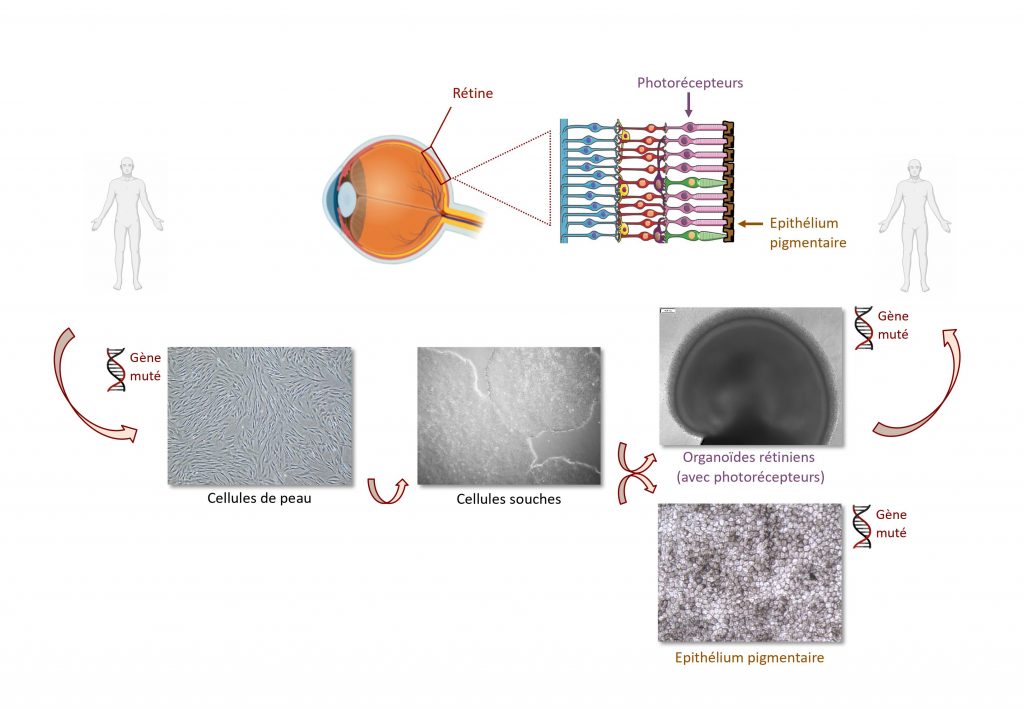
Vasiliki Kalatzis : En effet. La rétine est le tissu sensible à la lumière qui tapisse le fond de l’œil. Son dysfonctionnement ou sa dégénérescence ont pour conséquence une perte progressive de la vision. Dans un grand nombre de cas, les origines sont génétiques. Les maladies apparaissent à cause d’une mutation dans un gène particulier qui peut être transmis de génération en génération. Ces maladies sont appelées des dystrophies rétiniennes héréditaires (DRH).
A quel moment apparaissent les premiers signes de DRH ?
V. K. : Les DRH apparaissent souvent dans l’enfance ou l’adolescence. Cette perte de la vision est due à une dégénérescence des couches postérieures de la rétine : les photorécepteurs, cellules sensibles à la lumière et l’épithélium pigmentaire rétinien, leur tissu de soutien.
Vous parlez des DRH au pluriel. Pourquoi ?
V. K. : Plus de 270 gènes différents sont identifiés comme responsables des DRH. Des mutations dans le même gène peuvent par ailleurs donner lieu à des formes cliniques distinctes. De ce fait, chaque DRH est unique et suppose un protocole de recherche particulier pour sa compréhension et le développement de traitements. Il faut donc des modèles spécifiques pour les étudier.
Vous avez choisi de ne pas utiliser de modèles animaux pour réaliser votre recherche.
V. K. : Avec mon équipe, nous avons en effet relevé le défi de développer un modèle rétinien humain pertinent pour éviter le recours systématique aux modèles animaux. Nous avons pour cela utilisé des cellules souches humaines qui ont la capacité de se différencier en n’importe quel tissu du corps. Ces cellules souches ont été générées au laboratoire.

Expliquez-nous plus en détail votre méthode.
V. K. : Nous avons pris tout d’abord des cellules de peau de patients porteurs de mutations dans un gène cible. Nous y avons ajouté un cocktail de facteurs bien adapté au milieu de culture pour que ces cellules perdent leur identité de peau et deviennent des cellules souches. En fonction du gène ciblé, nous avons guidé la différentiation de ces cellules souches afin qu’elles deviennent de l’épithélium pigmentaire rétinien, ou des organoïdes rétiniens, petites structures tri-dimensionnelles qui contiennent une couche de photorécepteurs. La morphologie de ces deux tissus rétiniens dérivés des cellules souches est la même que dans l’œil humain. Ils reproduisent par ailleurs très bien leur fonctionnalité. Ce sont donc des outils très puissants pour étudier la rétine humaine, saine et pathologique, puisqu’ils portent la même mutation génique.
Vous êtes lauréate du prix Alfred Kastler 2021. Que représente pour vous cette distinction ?
V. K. : Ce prix est pour moi une véritable reconnaissance de notre travail au cours de cette dernière décennie. Il récompense tous les efforts que mon équipe a fourni afin de mettre en place ces modèles humains comme alternative aux modèles animaux. Ce n’était pas facile au début de convaincre d’autres chercheurs de la valeur de notre approche. Aujourd’hui, il y a de plus en plus d’équipes qui utilisent ces modèles pour étudier différents organes, pas seulement la rétine. Être lauréate de ce prix c’est un peu comme avoir une validation de notre approche. Je remercie le jury pour cet honneur.

