Quel est votre parcours ?
Après un DEA « Systèmes biologiques intégrés » à l’Université d’Orsay et une thèse en pharmacologie moléculaire, j’ai réalisé un premier post-doc à l’Institut Cochin portant sur le développement de molécules à visée thérapeutique contre l’obésité. Je suis ensuite partie à Stockholm pour un second post-doc et en revenant j’ai décidé de développer mon projet d’étude qui était de comprendre et de contrer un effet secondaire, la lipodystrophie, de la trithérapie utilisée pour lutter contre le virus VIH.
J’ai été recrutée par le CNRS en tant que chargée de recherche. En développant mon projet sur la lipodystrophie induite par les drogues anti-VIH, j’ai réalisé qu’allier mes recherches et les volontés des industries pharmaceutiques qui souhaitaient mettre au point un produit à des fins économiques devenaient difficiles. J’ai orienté alors mes travaux sur la compréhension des mécanismes régissant l’apparition de tissu adipeux dans un muscle malade. Je voulais savoir d’où venait ce tissu dans le cadre des maladies musculaires, les myopathies.
Par la suite j’ai intégré le Généthon dans l’équipe du Dr Luis Garcia pour travailler sur les traitements de la Dystrophie Musculaire de Duchenne (DMD). L’équipe de Luis Garcia a ensuite déménagé au Centre de recherche en myologie, un laboratoire sous la tutelle de l’Inserm et de Sorbonne Université. Il est parti en 2012 et je suis devenu co-cheffe d’équipe avec le professeur Thomas Voit. Je suis devenue cheffe d’équipe en 2015 après le départ de ce dernier.

J’ai passé le diplôme HDR (habilitation à diriger des recherches) en 2014 et j’ai été reçue au concours DR (Directrice de recherche) au CNRS en 2018.
Quelles sont les approches thérapeutiques envisagées pour le traitement de la DMD ?
La Dystrophie Musculaire de Duchenne (DMD) est une maladie génétique rare et aujourd’hui incurable, qui provoque une dégénérescence du tissu musculaire. L’origine de cette maladie est la mutation du gène codant la dystrophine, une protéine indispensable au maintien de l’intégrité des fibres musculaires au cours des processus de contraction.
Le premier obstacle est que ce gène est l’un des plus grand du génome humain. Il était alors impossible d’utiliser la thérapie génique classique et d’apporter aux cellules une version intégrale non mutée de ce gène.
L’idée est alors de venir avec un outil particulier pour faire sauter la mutation au niveau de l’ARN pré-messager. En effet la maturation de l’ARN pré-messager en ARN messager se fait grâce au mécanisme d’épissage. Certaines séquences non-codantes (les introns) vont alors être retirées pour ne garder que les séquences codantes d’intérêts (les exons). Il s’agissait donc de détourner la machinerie d’épissage pour qu’elle enlève en plus des introns, l’exon portant la mutation. C’est ce que l’on appelle le « saut d’exon » et ce fut une véritable avancée dans ce domaine.
Quand je suis arrivée au sein de l’équipe je me suis intéressée aux mécanismes de dégénérescence du muscle malade et ainsi j’ai pu développer des stratégies pour optimiser la thérapie de la DMD. Le saut d’exon est aujourd’hui en phase d’essais cliniques.
Une autre stratégie de thérapie pour la DMD consiste à raccourcir le plus possible la séquence codante de la dystrophine pour pouvoir atteindre la taille d’une séquence pouvant être intégrer dans un vecteur viral et ainsi permettre la restauration d’une dystrophine plus petite mais fonctionnelle : la micro-dystrophine. Il a fallu des années d’étude pour comprendre quelles étaient les séquences dispensables et indispensables de cette protéine.
Aujourd’hui mon travail consiste à combiner ces deux approches, saut d’exon et thérapie génique avec la micro-dystrophine, qui ont chacune des avantages et des inconvénients. Ce travail d’optimisation se fait en en partenariat avec l’industrie pharmaceutique qui dirige les essais cliniques.
Aujourd’hui mon travail consiste à combiner ces
deux approches : saut d’exon et thérapie génique
Comment fonctionne la thérapie génique ?
La thérapie génique est basée sur l’utilisation d’un vecteur virale. Pour amener une séquence d’intérêt dans les cellules cibles afin qu’elle s’exprime, on utilise des virus. Pour cibler le muscle on utilise des adénovirus associés (AAV) qui sont des virus non pathogènes. On peut modifier leur patrimoine génétique pour y introduire n’importe quelle séquence d’intérêt de taille adéquate. On va alors injecter le vecteur viral qui va allez dans le muscle et utiliser les cellules musculaires pour produire son matériel génétique contenant nos nouvelles séquences. L’un des défauts de cette méthode est que lorsque l’on utilise des vecteurs viraux on ne peut pas venir deux fois, quand l’organisme reconnait le corps étranger la seconde fois le système immunitaire détruit ces vecteurs.
Dans le cas du saut d’exon on utilise des molécules chimiques qui vont allez dans le noyau des cellules et feinter la machinerie d’épissage. Elles vont se coller au niveau de séquences d’épissages, ainsi l’exon muté n’est plus reconnu. Contrairement à la thérapie génique utilisant les AAV il s’agit d’un traitement qui doit être pris constamment.
Dans le cas de la DMD on peut combiner les deux approches, les AAV mettent un certain temps à produire la micro-dystrophine, la fibre musculaire malade casse vite, il y a un risque de perdre l’apport thérapeutique. De plus les essais cliniques concernant le saut d’exon seul ont été décevants : il fallait mettre des doses énormes avec peu d’effet. L’objectif est donc de réussir à combiner ces deux approches pour une efficacité maximum.
Comment améliorer le partage des connaissances génétiques aujourd’hui ?
Depuis 2016 je suis la coordinatrice nationale de l’action « 1000 chercheurs dans les écoles ». Cette opération est organisée par l’AFM-Téléthon. On se déplace pour expliquer ce qu’est la génétique. Plus de 30 000 élèves de collèges et lycées rencontrent des experts scientifiques (chercheurs, ingénieurs, techniciens…) dans toute la France chaque année. Le but est d’initier une rencontre entre les personnes qui travaillent sur les maladies génétiques, quel que soit leur métier, et les jeunes. Ces rencontres ont pour objectifs d’amener des informations différentes de leurs cours de SVT classiques, d’avoir un partage de l’intervenant sur son métier, de sensibiliser au handicap, grâce à films des témoignages de jeunes que nous partageons : comprendre c’est accepter.
Quel est pour vous l’avenir de la recherche en génétique ?
Il faut parler du prix Nobel. Toute cette nouvelle approche de la technologie CRISPR-CAS 9 a aussi été un saut technologique très important. Cependant à partir du moment où ça touche directement notre ADN, notre génome, on comprend que de nombreuses précautions doivent être prises, scientifiques mais aussi éthiques. Il va falloir du temps avant que l’on puisse expérimenter cette stratégie chez l’homme.
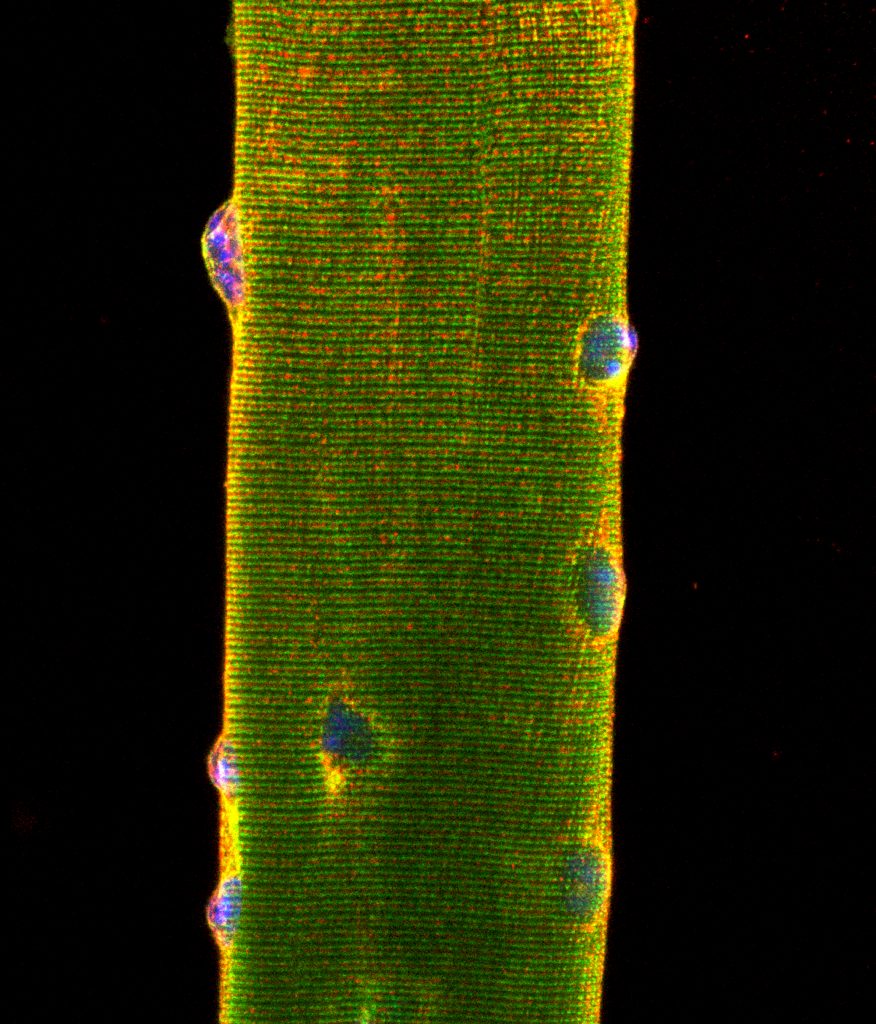
Fibre musculaire isolée à partir de Tibialis Anterior de souris. Marquage en immunofluoresence vert DHPR, rouge RYR1, bleu noyaux. Image microscope confocal.
Pour boucler sur l’actualité je pense que toutes les recherches en thérapie génique menées ces dernières années, ont été très utiles pour le développement des vaccins à ARN contre la Covid-19 qui utilisent des adénovirus comme vecteur.
Le premier médicament utilisant la thérapie génique pour une maladie neuromusculaire a été mis sur le marché en 2019 pour l’amyotrophie spinale. D’autres vont suivre dans les prochains mois pour d’autres myopathies.



