1 562 086, c’est le nombre de donneurs de sang en 2020. Soit 2 421 930 poches de sang, 301 283 poches de plasma et 96 215 poches de plaquettes. Les plaquettes c’est d’ailleurs l’objet d’étude de l’équipe 2 (Biologie de la Mégacaryopoïèse** et de la Thrombopoïèse) de l’UMRS 1255 – Biologie et pharmacologie des plaquettes sanguines.
Cette unité mixte située à Strasbourg est placée sous la tutelle de 3 établissements : l’EFS – Etablissement Français du Sang, l’Inserm et l’Université de Strasbourg.
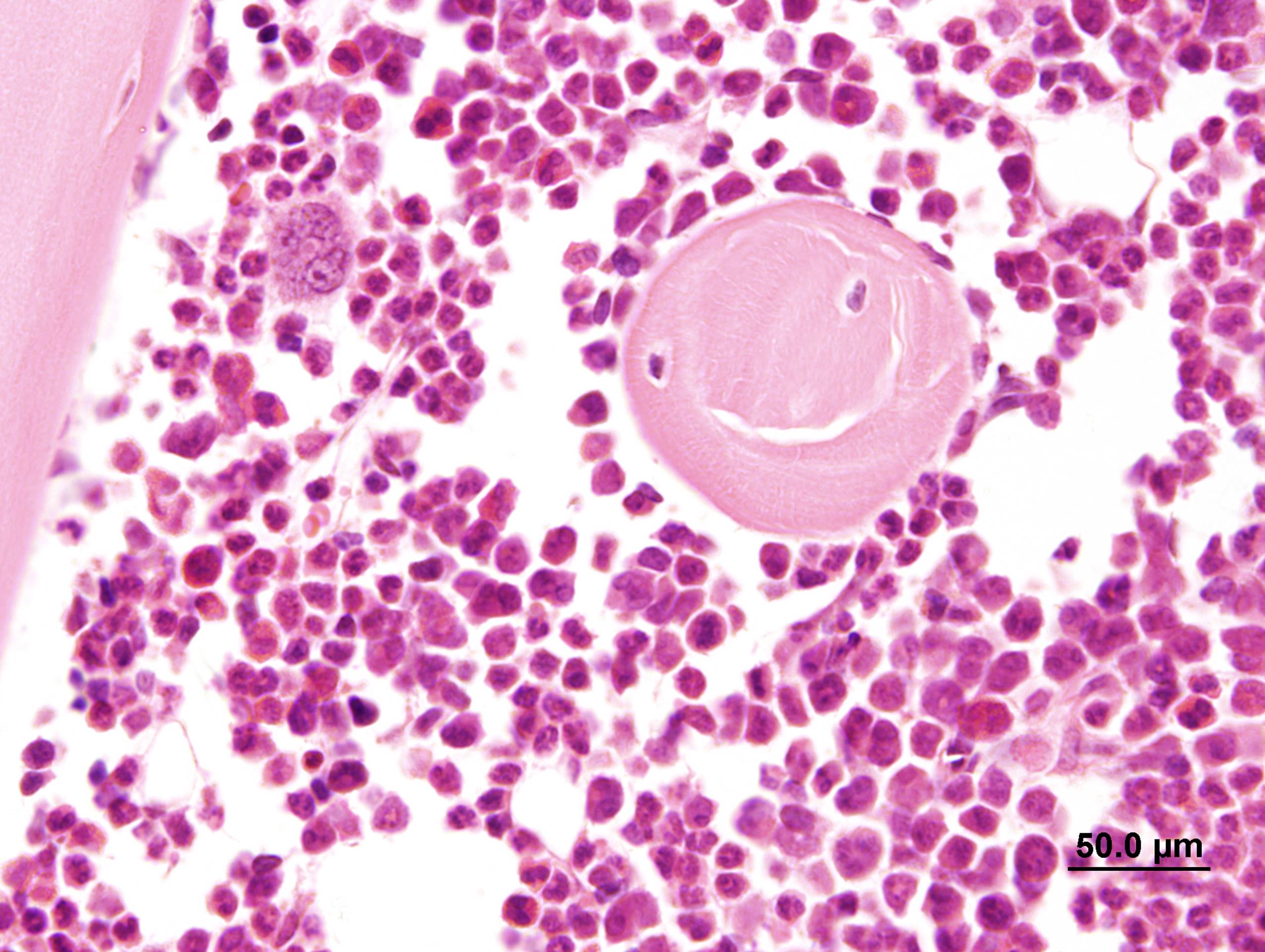
Ce laboratoire est composé d’environ 40 collaborateurs. Ensemble, chercheurs, médecins, techniciens et ingénieurs ont pour objectif de faire progresser les connaissances sur les plaquettes sanguines. Comme toutes les cellules sanguines, elles dérivent des cellules souches hématopoïétiques et naissent à la suite d’un processus complexe de différenciation et de maturation.
Si les connaissances progressent, de nombreuses questions se posent encore. L’équipe s’attache ainsi à mieux comprendre les mécanismes moléculaires et cellulaires qui gouvernent ces différentes étapes avec comme objectif de mieux appréhender certaines pathologies plaquettaires et de de produire à terme des plaquettes in vitro afin d’en faire un futur biomédicament à visée transfusionnelle au service des patients (états réfractaires, thrombopénies allo-immunes).
À travers ce reportage découvrez les recherches de l’équipe Biologie de la Mégacaryopoïèse et de la Thrombopoïèse.
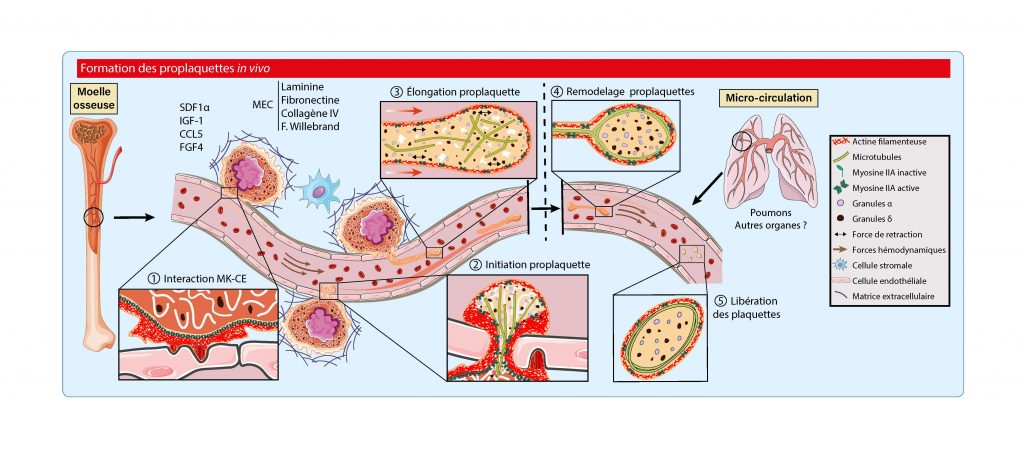
De la formation des plaquettes …
Catherine Leon obtient son diplôme d’Ingénieur en Biotechnologie à l’ESBS (Strasbourg) en 1990, et un doctorat en Biologie Cellulaire et Moléculaire, option Neurosciences, à l’Université Louis Pasteur (Strasbourg I) en 1993. « Après mon doctorat, je souhaitais absolument faire de la recherche fondamentale, c’est ce qui me plaisait vraiment. » nous raconte-t-elle. Elle débute alors à l’EFS avec le projet d’identifier et cloner le récepteur de l’ADP, un des récepteurs d’activation des plaquettes sanguines cible de médicaments antithrombotiques. En 1998, elle intègre l’Inserm et devient Directeur de Recherche en 2016. Bien qu’au départ, elle s’intéresse aux fonctions des plaquettes, en 2007, elle se penche sur leurs mécanismes de formation. Une pathologie en particulier retient son attention : la maladie liée au MYH9*. Une pathologie empêchant la production en grand nombre de plaquettes fonctionnelles et entrainant des risques hémorragiques.
De fil en aiguille, elle s’intéresse à la mécanobiologie, domaine en plein développement reconnu depuis seulement une vingtaine d’années, étudiant le ressenti des cellules face à leur environnement physique et mécanique. MYH9 y joue un rôle clé. Les cellules sont capables de sentir les compressions, les étirements ou même les rigidités et de s’y adapter en régulant leur cytosquelette, modifiant le comportement et le devenir de ces cellules. L’identification de ces nouvelles voies est nécessaire pour pouvoir mimer in vitro les signaux provenant des contraintes mécaniques naturellement présentes dans la moelle osseuse. « Activer les différentes voies de signalisation au plus proche de ce qui existe dans la moelle permettra d’augmenter les rendements de production de plaquette en bioréacteur, un milieu nécessairement liquide pour une production à grande échelle ».
D’un point de vue physiopathologique, une augmentation de la rigidité de la moelle osseuse et des contraintes physiques est observée chez des patients développant des myélofibroses, pathologie majoritairement cancéreuse. « Dans ce cas, du tissu fibreux rigide prend la place du tissu hématopoïétique très peu rigide ». A l’inverse, les chimiothérapies qui détruisent un certain nombre de cellules de la moelle entrainent une diminution des contraintes physiques.
Il est donc important de comprendre comment les plaquettes sont formées, non seulement pour pouvoir un jour les produire in vitro en grande quantité, mais aussi pour soigner les patients qui ont un défaut de production de plaquettes du fait de maladies héréditaires ou acquises, ou en réponse à des traitements

*Le gène MYH9 code pour la myosine et donc le cytosquelette de toutes les cellules.
**Mégacaryopoïèse : processus par lequel une cellule progénitrice hématopoïétique se différencie en une cellule polyploïde de grande taille, le mégacaryocyte, capable, lors de la thrombopoïèse, d’aboutir à la libération des plaquettes sanguines.
… à leur production
Après un doctorat en Biologie des Cellules Sanguines à l’Université Denis-Diderot à Paris, Alexandra Mazharian a effectué 2 stages postdoctoraux à l’Université de Birmingham en Angleterre suivi de 8 années en tant que chercheure à l’Institut Cardiovasculaire de Birmingham. « Tout au long de ma carrière, je me suis intéressée aux mécanismes moléculaires et cellulaires qui régulent les fonctions plaquettaires mais également la production des plaquettes sanguines à partir de leur cellule mère le mégacaryocyte ». De par des expériences acquises à l’étranger, elle intègre en 2019, l’EFS de Strasbourg en tant que chargé de recherche, où elle mène actuellement ses travaux centrés sur les voies de signalisation impliquées dans la formation des plaquettes.
Je cherche à identifier quelles sont les voies de signalisation intrinsèques aux mégacaryocytes, responsables de la production des plaquettes, en mettant l’accent sur les mécanismes inhibiteurs, qui ont été très peu étudiés jusqu’à présent.
Le projet d’Alexandra s’axe plus particulièrement à élucider le rôle d’une famille de protéines appelées les tyrosines phosphatases Shp1 et Shp2 et à déterminer comment elles régulent la production des plaquettes en conditions physiologiques, mais également à élucider leur implication dans des pathologies telles que les néoplasmes myéloprolifératifs et la myélfibrose, où la production aberrante de mégacaryocytes et de plaquettes est centrale à la pathologie, due à une signalisation constitutive.
« L’élucidation du rôle de ces phosphatases et de la façon dont elles sont régulées pourrait conduire à des cibles thérapeutiques nouvelles et améliorées pour le traitement de ces maladies et potentiellement d’autres maladies connexes ». Ces recherches se trouvent ainsi au carrefour de la biologie et de la biochimie.
Le pouvoir des images
Anita Eckly-Michel a obtenu son doctorat à la Faculté de pharmacie et a ensuite rejoint l’EFS, d’abord en tant que post-doctorante, puis en tant que responsable du laboratoire de microscopie électronique. A ce titre, elle travaille en étroite collaboration avec les différents chercheurs de l’unité et contribue à leurs différents travaux, qu’il s’agisse d’études sur la moelle osseuse, la thrombopoïèse, les pathologies plaquettaires, ainsi que des travaux concernant la génération de plaquettes in vitro.
Elle mène aussi ses propres recherches qui portent sur les derniers stades de la maturation des mégacaryocytes, lorsque ces derniers sont prêts à libérer les plaquettes dans la circulation sanguine. Une étape clé et encore mal comprise concerne le passage des mégacaryocytes à travers la barrière des micro-vaisseaux, ce qui permet de libérer des fragments cytoplasmiques dans le sang, qui se remodèlent ensuite en plaquettes dans la circulation. La question qui se pose est de savoir comment le mégacaryocyte franchit cette barrière continue : « Nous nous sommes rendus compte, explique Anita, que le mégacaryocyte utilise des structures particulières, appelées podosomes, pour perforer la paroi endothéliale, forçant ainsi le passage et permettant la libération des plaquettes ». Ces travaux sont encore en cours, et de nombreuses questions restent en suspens, notamment en ce qui concerne les mécanismes moléculaires permettant d’initier ce passage. L’autre question qui anime Anita est de connaître le devenir des mégacaryocytes sénescents. Aujourd’hui, il y a très peu de travaux concernant cette cellule particulière. Comment est-elle éliminée ? Quelle est sa pertinence biologique ? Les mégacaryocytes sont des cellules rares dans la moelle osseuse. Pour les visualiser, nous avons besoin de systèmes d’imagerie adaptés à cette étude.
À l’EFS, nous avons la chance de disposer de nombreux équipements de pointe, incluant le microscope FIB-SEM. L’EFS a été l’un des premiers laboratoires français à s’équiper d’un microscope FIB-SEM, offrant ainsi la possibilité d’imager l’ultrastructure de cellules entières in situ et de réaliser des reconstructions 3D complètes à l’échelle nanométrique. En 2019, un nouveau microscope est venu compléter la plateforme, un microscope multiphotonique qui va nous permettre d’étudier la dynamique de nos événements cellulaires in vivo.… C’est clairement la force du laboratoire, nous bénéficions de microscopes de toutes dernières générations pour visualiser, comprendre et faire progresser au mieux nos réflexions scientifiques
Un essai clinique en vue
Après sa thèse et son post-doctorat qu’elle a réalisé au sein du laboratoire de l’EFS Grand Est, Catherine Strassel est devenue chercheure affiliée à l’EFS. Tout d’abord intéressée par la fonction des plaquettes, elle s’est peu à peu tournée vers la compréhension des mécanismes qui mènent à la production de plaquettes en développant un modèle murin reproduisant une pathologie plaquettaire, le syndrome de Bernard-Soulier. En plus de défaut fonctionnel des plaquettes, cette pathologie se traduit par une diminution importante du nombre de plaquettes et l’apparition de grandes plaquettes. C’est la volonté de comprendre les mécanismes moléculaires et cellulaires qui sous-tendent la formation des plaquettes, qui a conduit Catherine et son équipe à développer des systèmes d’études in vitro de la formation des plaquettes. Elle a ainsi pu mettre en place tout d’abord des modèles de culture, récapitulant les différentes étapes de formation des plaquettes, à partir de progéniteurs hématopoïétiques (PH) murins, qu’elle a ensuite étendu au développement de modèles humains : « En ayant développé ces modèles murins il était intéressant de pouvoir avoir un modèle humain. Depuis 10 ans maintenant, j’ai commencé à étudier la mégacaryopoïèse à partir des PH humains de types CD34 +.
Ces travaux lui ont permis de développer et de breveter i) une méthode de culture efficace pour la production de mégacaryocytes matures à partir de PH humains issus du sang périphérique et ii) deux dispositifs de libération de plaquettes. Elle a déjà pu montrer dans un modèle préclinique que les plaquettes humaines recirculaient après transfusion et qu’elles étaient capables d’assurer la fonction principale des plaquettes, l’arrêt des saignements. Forte de cette expérience, Catherine et son équipe sont en cours de déploiement de cette technologie pour réaliser un essai clinique afin de valider la recirculation des plaquettes produites chez des volontaires sains. L’équipe s’attache aujourd’hui à rendre le procédé développé compatible avec les prérequis industriels pour un médicament de thérapie innovante (MTI) (le statut juridique dérogatoire qu’a obtenu la plaquette de culture pour cet essai). L’ensemble du procédé a donc été transféré à la plateforme MTI de Besançon (plateforme qui appartient à l’EFS).
Nous sommes actuellement en phase de développement des lots cliniques pour un début d’essai premier trimestre 2023. J’ai bénéficié des recherches de chacun pour développer un procédé de culture optimal et libérer suffisamment de plaquettes pour imaginer cet essai.
Cet essai est une étape clé pour envisager les plaquettes de culture comme un futur biomédicament à visée transfusionnelle. Un biomédicament qui n’aura pas vocation à remplacer le don du sang mais qui pourrait répondre à des impasses transfusionnelles comme les états réfractaires, état où le système immunitaire des patients, déjà multi-transfusé, détruit rapidement les plaquettes transfusées suite à la présence d’anticorps anti-HLA de classe I. Pour faire face à cette difficulté thérapeutique, Catherine annonce “Notre objectif est de développer des plaquettes dites universelles à la demande ”, c’est-à-dire des plaquettes rendues immuno-compatibles en éliminant par génie génétique (CRISPR/cas9) la protéine HLA de type I.
La production de plaquettes universelles serait une amélioration évidente de la prise en charge de ces patients, en couvrant mieux le risque hémorragique de leur pathologie ou de leur traitement et permettrait à l’EFS d’assurer, à terme, l’autosuffisance dans des situations logistiques tendues (congés, épidémies, intempéries).