Des chercheurs marseillais identifient un nouveau mécanisme d’échappement bactérien
Une équipe de chercheurs du Centre d’Immunologie de Marseille-Luminy (CIML, Inserm U1104 et UMR7280) vient de réaliser une découverte majeure qui pourrait révolutionner le traitement des infections bactériennes chroniques. Sylvie Mémet, CRHC CE Inserm, Jean-Pierre Gorvel, DR1 CE CNRS et leurs collaborateurs, ont mis en lumière un mécanisme inédit expliquant comment une bactérie intracellulaire parvient à se cacher dans l’organisme pendant de longues périodes et à échapper ainsi au système immunitaire.
Au cœur de cette découverte se trouve l’omentum, un organe lymphoïde tertiaire situé dans le tissu adipeux de l’abdomen. Les chercheurs ont découvert que cet organe sert de refuge à la bactérie Brucella abortus, responsable de la brucellose, une maladie grave affectant aussi bien les animaux que les humains.
« Nous avons identifié un mécanisme complexe où la bactérie manipule activement son environnement immunitaire », explique Sylvie Mémet, qui a co-dirigé l’étude avec Jean-Pierre Gorvel. « La bactérie déclenche l’accumulation dans l’omentum, jusqu’en phase chronique d’infection, de cellules immunitaires particulières, appelées cellules myéloïdes PD-L1+Sca‑1+, qui, au lieu de la combattre, créent un environnement propice à sa survie. ». Cette accumulation cellulaire est maintenue par un composant spécifique d’une molécule de surface de la bactérie (LPS).
L’équipe a découvert que ces cellules produisent une molécule immunosuppressive appelée IL-1RA, qui inhibe la réponse immunitaire normale. Ce mécanisme est déclenché par le LPS de Brucella abortus, qui possède une structure singulière qui le distingue de celui d’autres bactéries comme E. coli. Les chercheurs ont également observé que ce phénomène s’accompagne de l’apparition de lymphocytes T particuliers, portant les marqueurs PD‑1 et LAG‑3, qui sont inhibés dans leur fonction.
De façon remarquable, ces observations faites chez la souris trouvent un écho chez l’homme : les patients atteints de brucellose présentent des taux élevés d’IL-1RA et de GM-CSF dans leur sang, ainsi qu’une augmentation de l’expression des gènes PD-L1 et LAG‑3.
Cette découverte ouvre des perspectives thérapeutiques prometteuses. « En ciblant spécifiquement les molécules PD-L1, Sca‑1, ou IL-1RA, nous pourrions développer de nouvelles stratégies pour combattre non seulement la brucellose, mais potentiellement d’autres infections bactériennes chroniques », soulignent les chercheurs. Ces résultats pourraient même avoir des implications dans d’autres domaines, comme l’immunothérapie du cancer.
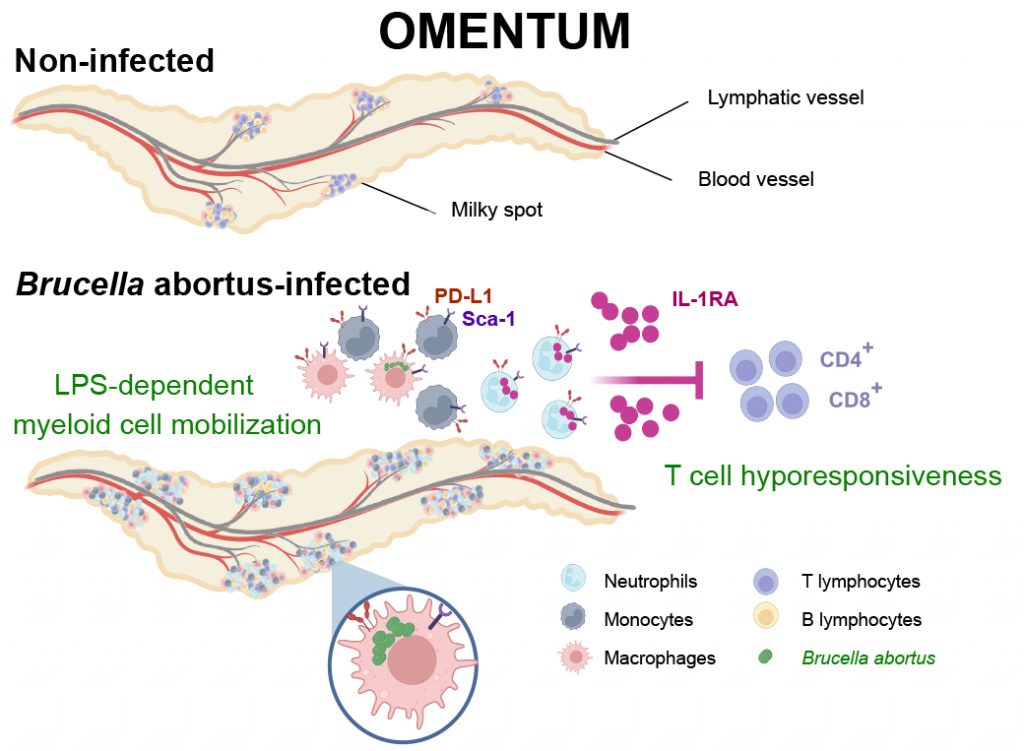
Lors de l’infection, B. abortus se multiplie dans les macrophages de l’omentum, un organe lymphoïde qui sert de réservoir à la bactérie. Via son LPS, B. abortus recrute localement des cellules myéloïdes qui produisent de l’IL-1RA. Cette molécule affaiblit la réponse des lymphocytes T, favorisant probablement la persistance de la bactérie dans l’omentum. Ce mécanisme pourrait également être présent dans la brucellose humaine.
Contacts chercheurs
Sylvie Mémet, CRHC CE Inserm,
Jean-Pierre Gorvel, DR1 CE CNRS
Centre d’immunologie de Marseille-Luminy (CIML – AMU/CNRS/Inserm)