Dans quel contexte faites-vous ces recherches ?
“Le contexte remonte à une observation très ancienne faite au début des années 1980, où il a été découvert que les molécules de la matrice extracellulaire pouvaient être adhésives comme la fibronectine ou antiadhésive comme la tenascine‑C. A l’époque il a été montré que la fonction adhésive de la fibronectine pouvait être supprimée avec la tenascine‑C. Nous avons donc voulu comprendre son fonctionnement. L’observation de l’interaction entre la tenascine‑C et la fibronectine a permis de montrer que la tenascine‑C se liait à deux endroits différents de la fibronectine. Nous avons alors mis en évidence des séquences de motifs communes aux deux molécules que nous avons appelées Maremo (matrice regulatif motif). Parallèlement nous avons également étudié l’interaction entre la tenascine‑C et d’autres molécules notamment de type chimio-attractive* : la tenascine‑C se lit à ces molécules de manière à créer un substrat adhésif pour les cellules immunitaires qui en temps normal ne se fixent pas à la tenascine‑C.
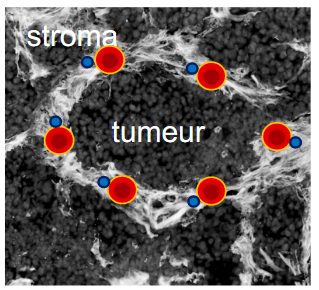
En condition de tumeur, les regroupements de cellules tumorales sont entourés de stroma (composé de tenascine‑C et d’autres molécules matricielles telles que la fibronectine, les collagènes etc.). La tenascine‑C, dans un environnement stromal lie les molécules de types chimio-attractive. Elle sert ainsi de substrat adhésif pour les cellules immunitaires. Nous avons décrit ce mécanisme d’inhibition de la réponse immunitaire antitumorale par rétention matricielle et nommé « TIL (tumor infiltrating leukocytes) matrix retention ».Lorsque nous retirons la tenascine‑C ou inhibons la rétention matricielle TIL, les propriétés de la tumeur se modifient de façon à laisser passer les cellules immunitaires qui peuvent alors combattre la tumeur (décrit plus en détail dans 3 articles récents : Spenle et al., Cancer Immun Res 2020 ; Deligne et al., Cancer Immun Res 2020 and Murdamoothoo et al., EMBO Mol Med 2021). »
*molécules types chimio-attractives désignent des molécules solubles qui attirent les leucocytes sur le site d’inflammation ou le site tumoral.

Pourquoi cette découverte est importante ?
“La séquence Maremo pourrait être utilisée pour diagnostiquer les cancers et un système immunitaire inefficient mais aussi pour activer les cellules immunitaires afin de leurs permettre d’intégrer la tumeur et ainsi la détruire. Elle pourrait être utilisée en thérapie en tant que point de contrôle du système immunitaire. Nous supposons que lorsque nous inhibons la fonction adhésive de la ténascine‑C présente dans la matrice, nous avons une meilleure immunité contre le cancer. “
Quelles sont les prochaines étapes ?
“Nous aimerions voir si le Maremo et les nanocorps (possédant des effets similaires que nous avons décrits en 2021 dans Frontiers Immunology (Dhaouadi et al.)) sont actives in vivo. Nous avons breveté ces nanocorps (avec le groupe de B. Bouhaoula de l’Université de Tunis) et la séquence Maremo. Il s’agirait à présent d’étudier deux cas :
- L’impact de Maremo et des nanocorps sans autres molécules thérapeutique sur la restauration de l’immunité anti-tumorale et pour réduire la fibrose
- L’impact de Maremo et des nanocorps couplés à d’autres molécules thérapeutiques pour voir s’il y a un effet amélioré qui pourrait réduire la croissance tumorale et inhiber les métastases. “
Consultez l’article
Interview réalisé par Ammra Tan