Vos recherches portent sur le syndrome de Wolfram. Pouvez-vous nous éclairer sur cette maladie génétique rare ?
Benjamin Delprat : Le syndrome de Wolfram est une maladie génétique orpheline qui affecte le pancréas, l’œil et la cochlée. Cette maladie a été décrite pour la première fois en 1938 par les médecins Wolfram et Wagener qui étudiaient alors une fratrie atteinte de diabète, d’atrophie optique et de surdité neurosensorielle.
On estime que le syndrome de Wolfram touche une centaine de personnes en France et environ 30.000 personnes dans le monde. Une quarantaine de laboratoires internationaux travaillent sur cette pathologie très invalidante et sévère.
Quels sont les symptômes de cette maladie et comment la diagnostique-t-on ?
B. D. : La maladie commence vers l’âge de 6 ans par un diabète juvénile. L’enfant rencontre par la suite des troubles de la vision. Sur la base de ces deux manifestations, l’ophtalmologue le plus souvent, demande le séquençage du gène WFS1 responsable majeur du syndrome de Wolfram. Si ce gène présente des mutations dites « bi-alléliques », le diagnostic est confirmé.
Vers l’adolescence, le patient souffre d’un diabète insipide et d’une surdité neurosensorielle. D’autres symptômes peuvent apparaitre comme une ataxie, des troubles urinaires, des désordres psychiatriques de type tendance suicidaire ou anxiété accrue. A ce jour, il n’existe aucune réponse thérapeutique générale pour enrayer la maladie. Chaque symptôme est soigné séparément et la prise en charge est multidisciplinaire. Les patients décèdent vers l’âge de 35 ans par une fausse route ou un déficit respiratoire suite à une dégénérescence du tronc cérébral.
Quels sont les facteurs responsables de l’apparition de la maladie ?
B. D. : Le syndrome de Wolfram est le plus souvent dû à des mutations du gène WFS1. La transmission de la maladie est dite autosomique récessive, c’est-à-dire que le patient présente une mutation sur le gène WFS1 provenant à la fois de son père et de sa mère. Une altération d’un autre gène peut entrainer le syndrome de Wolfram, dans des proportions toutefois extrêmement limitées puisqu’elle ne concerne pas plus d’1% des patients dans le monde.
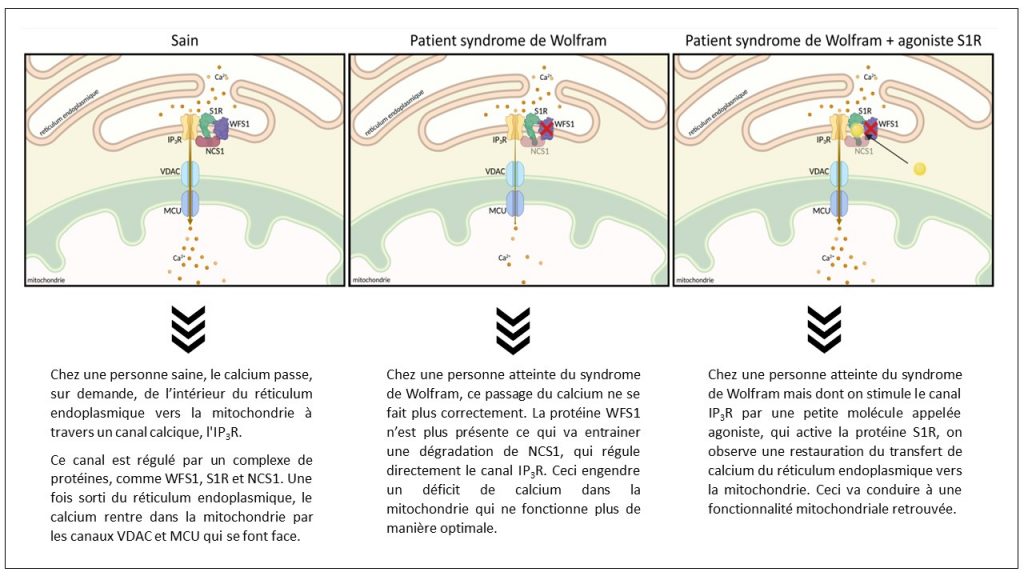
La wolframine, protéine codée par le gène WFS1 et déficiente dans le syndrome de Wolfram, est nécessaire pour la bonne communication entre deux organelles essentielles de la cellule : le réticulum endoplasmique qui est un peu la réserve majeure de calcium de la cellule et la mitochondrie ou centrale énergétique de la cellule. Schématiquement, la wolframine contrôle l’ouverture du robinet qui fait passer le calcium du réservoir vers la centrale énergétique lorsqu’elle en a besoin. La centrale ne tourne plus correctement, ce qui entraine un mauvais fonctionnement de la cellule et sa mort.
Quelles sont les conséquences quotidiennes de cette pathologie neurodégénérative ?
B. D. : Cette maladie altère considérablement la qualité de vie des patients. Les enfants doivent contrôler leur glycémie dès leur plus jeune âge en se faisant des piqûres d’insuline. A partir du moment où leur acuité visuelle diminue, leur capacité à suivre des cours ou à prendre simplement du bon temps est impactée. Malheureusement, cette diminution de l’acuité visuelle se termine souvent par une cécité légale, entrainant une perte importante de leur autonomie. Lorsque le diabète insipide et la surdité neurosensorielle s’installent, le patient devient extrêmement dépendant de ses parents qui doivent le plus souvent cesser leur activité professionnelle. Enfin, la dégénérescence des structures qui contrôlent la respiration et la déglutition entraine souvent un décès prématuré.
Avec votre équipe, vous venez de publier un article dans Science Translational Medicine sur l’identification d’une cible thérapeutique capable de traiter les symptômes du syndrome de Wolfram. Expliquez-nous.
B. D. : Cette publication fait suite à un travail collaboratif que j’ai réalisé à l’Institut des Neurosciences de Montpellier avec Cécile Delettre, Directrice de recherche Inserm. Nous avons montré que la wolframine servait de modulateur pour faire passer le calcium du réticulum endoplasmique vers la mitochondrie, sur demande. Nous avons par ailleurs constaté que la wolframine contrôlait le débit en protégeant son partenaire, NCS1, de la dégradation. De manière tout à fait intéressante, lorsque l’on ramenait le niveau d’expression de NCS1 à un niveau physiologique, on corrigeait les déficits cellulaires. C’est à partir de ce résultat inattendu que j’ai décidé de rejoindre le laboratoire de Tangui Maurice qui travaille depuis plus de 30 ans sur la protéine sigma‑1 régulatrice de ce mécanisme. J’étais persuadé que ce récepteur était l’élément de régulation qui me permettrait de forcer l’ouverture du modulateur pour favoriser le transfert du calcium.
L’intérêt majeur de cette « clé à molette » est qu’elle peut être activée par des petites molécules, médicaments potentiels. Nous avons utilisé un agoniste de référence, le PRE-084 pour mettre en exergue l’efficacité de cette clé dans la restauration des déficits cellulaires et comportementaux.
Ce mécanisme a une application directe sur le syndrome de Wolfram, mais également sur d’autres pathologies qui ont un problème « d’ouverture du robinet » comme certaines maladies neurodégénératives telles qu’Alzheimer, Parkinson, ou la sclérose latérale amyotrophique et métaboliques comme le diabète et la cardiomyopathie.
Quelles sont les prochains objectifs que vous vous fixez ?
B.D. : Le travail que nous venons de publier dans la revue Science Translational Medicine est une preuve de concept qui va nous permettre de développer un nouveau médicament pour traiter le syndrome de Wolfram. Nous avons utilisé un de nos modèles précliniques, le poisson – zèbre, pour cribler de nouvelles molécules dont on pense à priori qu’elles seraient de bons activateurs de la protéine sigma‑1. Nous avons identifié plusieurs molécules très prometteuses.
En parallèle, nous avons également démontré le rôle fondamental de la wolframine dans la régulation d’un processus vital de chaque cellule : l’autophagie. Cette fonction permet à la cellule d’éliminer les agrégats toxiques de protéine et de recycler les organelles qui ne fonctionnent pas de manière optimale. De façon tout à fait originale, la protéine sigma‑1 régule aussi l’autophagie. La difficulté est que nous ne connaissons pas les mécanismes par lesquels la protéine sigma‑1 module cette autophagie. C’est pour répondre à cette question fondamentale qu’avec mon équipe nous avons orienté nos recherches en utilisant des approches complémentaires de protéomique, transcriptomique, d’imagerie calcique et d’analyse de la fonction mitochondriale.

De g. à dr. : Tangui Maurice, Amandine Peyrel, Lucie Crouzier, Benjamin Delprat, Elodie Richard, Stacy Alves, Méghane Bataillard, Maëlle Debock, Sylvain Bartolami.
Membres absents : Johann Meunier, Laura Marchand.
Les personnes atteintes du syndrome de Wolfram peuvent-elles espérer à moyen terme bénéficier d’un traitement curatif ?
B. D. : Il est raisonnable de penser que nous serons en mesure de démarrer un essai clinique d’ici 5 ans. Nous avons la chance d’avoir au CHU de Montpellier, le centre de référence Maolya dirigé par Isabelle Meunier et Agathe Roubertie, qui suit les patients atteints du syndrome de Wolfram pour tout le sud de la France. Ces patients seront bénéficiaires du nouveau traitement dès qu’il sera en phase de test.


